
����Ŀ��̼��������FeCO3����һ����Ҫ�Ĺ�ҵ�Ρ�ijѧϰС�����FeSO4�Ʊ�FeCO3
������ʾ��FeCO3����ɫ�ᾧ��������ˮ������Ʒ�ڿ������ȶ���ʪƷ��¶�ڿ����л����������ɺ���ɫ��ˮ��������FeO(OH��
��1��ʵ��̽����
ʵ �� �� | ���� | ���� |
| 1����Ϻ���ְ�ɫ��״�����������ֳ����ʻ���ɫ�������ݲ��� 2������5-8���ӣ�����ɫ���������࣬���ձ�ɺ��ɫ |
������FeCO3���ӷ���ʽ��_________________________________��
�ڷ�Ӧ�����п�������Fe(OH)2��������__________________________________��
��ȡ�������ġ����ϴ�ӣ�������ϡ���ᣬ�����ܽ��������ݲ�����֤����ɫ�����к���CO32-����ʱ��Һ�д��ڵĽ�����������__________________________________��
��2��ʵ��̽����
ʵ��� | ���� | ���� |
| 1����Ϻ��Թ��г��ְ�ɫ����״���ǣ�Ƭ�̺��д������ݲ��� 2����ճ�����Թ��ڱڵİ�ɫ����״���DZ����ɫ����Խ��Խ�ࣻ20���Ӻ�ɫ�������Գ��� |
�پ����飬�Թ��а�ɫ����״������FeCO3�����ϻ�ѧ�����ƽ��ǶȽ��Ͳ����������ݵ�ԭ��______________________________________________��
�ڷ���������Ϊ��ʵ������ù�����FeCO3�ĺ�����ʵ���ࡣ֧�ָý��۵IJ������������£��ֱ����ֳ������Ĺ��ˡ�ϴ�ӡ�������ȡ�����������ֹ��壬___________________����۳�����
��3��ʵ��̽����
ʵ��� | ���� | ���� |
| 1����Ϻ��Թ��г��ְ�ɫ����״���ǣ�Ƭ�̺��д������ݲ��� 2��һ��ʱ����������ž��������Ľ��������Թܣ������5Сʱ���������ͣ��Թ��г�����ʼ�ձ��ְ�ɫ |
ʵ��Ľ�����ͼ��____________��
��4���ۺ�����ʵ�飬����˵����ȷ����__________
a.��NaHCO3�Ƶ�FeCO3���ȸߵ�ԭ��֮һ����ΪNaHCO3��Һ������
b.��1 L 1.0 mol/L NaHCO3������FeSO4��Һ��Ӧ�����Ͽ��Ʊ�116 g FeCO3
c.ʪƷFeCO3�ڿ����л��������ķ���ʽΪ 4FeCO3+O2+6H2O=4Fe��OH)3+4CO2
d.��ҵ����NH4HCO3��FeSO4��Ӧ���Ʊ����ȸ��ߵ�FeCO3
���𰸡� Fe2++ CO32-= FeCO3�� ��ɫ��״��ɻ���ɫ������ɺ��ɫ Fe3+ Fe2+ NaHCO3�д��ڵ���ƽ�⣺HCO3- ![]() H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ��ƽ�����ƣ�H+ + HCO3- = CO2 ��+H2O ������ϡ����������ܽ⣬ʵ����в����������ʵ����в���������� ��Ӧ�ų�CO2������Ӧ������O2�Ļ��� a d
H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ��ƽ�����ƣ�H+ + HCO3- = CO2 ��+H2O ������ϡ����������ܽ⣬ʵ����в����������ʵ����в���������� ��Ӧ�ų�CO2������Ӧ������O2�Ļ��� a d
�������������������1����̼����������������Ӧ����FeCO3������
��Fe(OH)2�ڿ����������ɰ�ɫ��״��ɻ���ɫ������ɺ��ɫ��
�����а�ɫ�����˵������FeCO3��������ɺ��ɫ˵������������������2����NaHCO3�д��ڵ���ƽ�⣺HCO3- ![]() H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3-
H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3- ![]() H+ +CO32-��ƽ�����ƣ�H+Ũ��������
H+ +CO32-��ƽ�����ƣ�H+Ũ��������
������̼���������ᷴӦ�ų�������̼�Ķ��ٷ�����
��3����Ӧ�ų�CO2������Ӧ������O2�Ļ�������ֹ������������
��4���ۺ�����ʵ�飬����˵����ȷ����__________
NaHCO3��Һ������������������Ũ��С��
b.��Ӧ���Ƕ�����̼���壬��1 L 1.0 mol/L NaHCO3������FeSO4��Һ��Ӧ�Ʊ�FeCO3����Ϊ0.5 mol��
c.ʪƷFeCO3�ڿ����л����������ܷų�������̼��
d. NH4HCO3��Һ����������Ũ�ȸ�С��
��������1����̼����������������Ӧ����FeCO3���������ӷ���ʽΪFe2++ CO32-= FeCO3����
��Fe(OH)2�ڿ����������ɰ�ɫ��״��ɻ���ɫ������ɺ��ɫ�����Ը��ݰ�ɫ��״��ɻ���ɫ������ɺ��ɫ���жϺ���Fe(OH)2��
�����а�ɫ�����˵������FeCO3��������ɺ��ɫ˵�����������������������ܽ����Һ�к���Fe3+ Fe2+����2����NaHCO3�д��ڵ���ƽ�⣺HCO3- ![]() H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3-
H+ +CO32-����FeSO4 ��Fe2+ + CO32- = FeCO3 ����HCO3- ![]() H+ +CO32-��ƽ�����ƣ�H+Ũ��������H+ + HCO3- = CO2 ��+H2O���ų�������̼��
H+ +CO32-��ƽ�����ƣ�H+Ũ��������H+ + HCO3- = CO2 ��+H2O���ų�������̼��
��̼���������ᷴӦ�ܷų�������̼�����Էų��Ķ�����̼Խ��˵������̼������Խ����
��3���Ľ�����ͼ������Ӧ�ų�CO2������Ӧ������O2�Ļ�������ֹ������������
��4���ۺ�����ʵ�飬����˵����ȷ����__________
NaHCO3��Һ������������������Ũ��С���������������������٣���a��ȷ��
b.��Ӧ���Ƕ�����̼���壬��1 L 1.0 mol/L NaHCO3������FeSO4��Һ��Ӧ�Ʊ�FeCO3����Ϊ0.5 mol����b������
c.ʪƷFeCO3�ڿ����л����������ܷų�������̼������ʽΪ12FeCO3 +3O2+6H2O = 4Fe��OH)3 + 4Fe2(CO3)3,��c������
d. NH4HCO3��Һ����������Ũ�ȸ�С�������������������������٣���d��ȷ


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹʪ���KI������ֽ�������ǣ�������
����ˮ ����ˮ �۵�ˮ ���Ȼ��� ���廯��
A. �٢� B. �٢ڢ� C. �٢ڢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�����Т�6.72 L CH4 ��3.01��1023��HCl ��13.6 g H2S ��0.2 mol NH3�����ж���������Ĺ�ϵ��ʾ����ȷ����
A. ����ܣ��٣��ۣ��� B. �ܶȢ٣��ܣ��ۣ���
C. �����ܣ��٣��ۣ��� D. ��ԭ�����ܣ��ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������Ϊ��������Ҫ������ϩ�����ƻ������顢�״������Ƽ�ȩ�ȡ�Ŀǰ���������г�������������ӵ����ơ���д���״����������Ʊ���ȩ�Ļ�ѧ����ʽ
________________________________________________________________��
��2����������ʹ�ù����У�������������ѡ���Խ��ͣ�һ��ʱ�����������ij������ʧЧ���������л��ղ�ʵ�������������������£�

��֪����������Ҫ�ɷ֣�X����ӫ�����������
Ԫ�� | Al2O3 | Ag | MgO | SiO2 | K2O | Fe2O3 |
����% | 82 | 14.8 | 1.4 | 0.9 | 0.5 | 0.1 |
���ϣ���X���������Ǽ�⣬�����������ľ���Ϊ���ͣ������ᡣ
�ٲ���a�Ͳ���b��������_________��
����д�����̢�������ϡ���ᷴӦ�����ӷ���ʽ
________________________________________________________________��
��3����Һ2 �к��ж��ֽ������ӣ��������������K+��ʵ�鷽��
____________________________________________________________________��
��4����ϻ�ѧ�����ƽ���ƶ��ǶȽ����̢����ð�ˮ���Ȼ��������ܽ��ԭ
��_______________________________________________________________��
��5�����̢������£�N2H4����Ϊ��ԭ�������в�����������ʡ���ԭ��ǿ���õ������ȸߵ��ŵ㣬�ù��̵Ļ�ѧ����ʽΪ��
________________________________________________________��
��6�����ù��̢�ʵ�������������������װ��ͼ���£�

д�����������ĵ缫��Ӧʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϡ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��

��ijͬѧ����������Ϣ���ƶ�B�ĺ�������Ų�����ͼ��ʾ����ͬѧ�����ĵ����Ų�ͼΥ��_________��BԪ��λ�����ڱ���������е�__________________����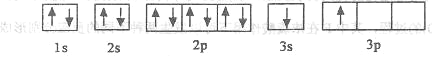
�� ACl2������A���ӻ�����Ϊ_________��ACl2�Ŀռ乹��Ϊ_________��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ__________________��
��д��һ����CN����Ϊ�ȵ�����ĵ��ʵĵ���ʽ____________��
���������������[Fe(CN)6]4�������__________________��
A.���ۼ� B���Ǽ��Լ� C����λ�� D���Ҽ� E���м�
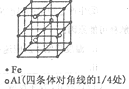
��3��һ��Al��Fe�Ͻ�����徧������ͼ��ʾ����ݴ˻ش��������⣺
��ȷ���úϽ�Ļ�ѧʽ__________________��
����������ܶ�=��g/cm3����˺Ͻ������������Feԭ��֮��ľ��루�ú����Ĵ���ʽ��ʾ�����ػ���Ϊ______cm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������ϵͳ��������ȷ����( )
A.2������3���嶡��
B.2������3����Ȳ
C.2������1����ϩ
D.4���һ���2���촼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������彡����ɽϴ�Σ������
A. ʹ��SO2Ư������
B. ����ˮ��ͨ������Cl2��������ɱ��
C. ��ʳ����ϴ��ˮƿ���ڱڸ��ŵ�ˮ��
D. ��С�մ��Ƹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽��,�Է���KCl��BaCl2���ֹ�������,�Իش�����������

��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ�����ᡣ
(1)��������������_________��
(2)�Լ�a��_________,�Լ�b ��_________ ��
(3)�����Լ�a��������Ӧ�����ӷ���ʽΪ_________��
�����Լ�b��������Ӧ�����ӷ���ʽΪ_________��
(4)�÷����ܷ�ﵽʵ��Ŀ��:_____(������������������)��������,Ӧ��θĽ�? _____������,���ʲ��ûش�).
(5)��Ҫ�ⶨԭ�������BaCl2����������������Ҫȷ���������������⡣���ٻ�Ҫ��õ�������_________��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϸ���2017������ν�ѧģ�⡿ijѧϰС��ͨ������װ��̽��MnO2��FeCl3��6H2O�ܷ�Ӧ����Cl2.

ʵ��������������±���
ʵ���� | ���� | ���� |
ʵ��1 | ����ͼ��ʾ����MnO2��FeCl3��6H2O ����� | ���Թ�A�в��ֹ����ܽ⣬�Ϸ����ְ��� ���Ժ�����ɫ���壬�ܱڸ��Ż�ɫҺ�� ���Թ�B����Һ���� |
ʵ��2 | ��A�еĻ���ﻻΪFeC13��6H2O, B����Һ��ΪKSCN��Һ�����ȡ� | A�в��ֹ����ܽ⣬���������ͻ�ɫ���壬B��KSCN��Һ��� |
�ش��������⣺
��l������ʵ���еİ�����_______���Թ�A�ܿ�������б��ԭ����_________
��2��ʵ��2˵����ɫ�����к���FeCl3��д��FeCl3ʹKI-������Һ���������ӷ���ʽ��___
��3��Ϊ��һ��ȷ�ϻ�ɫ�����к���Cl2����ѧϰС���ʵ��1������ָĽ�������
����1����A��B������ʢ��ij���Լ���ϴ��ƿC�����B����Һ�Ա�Ϊ��ɫ��
����2����B��KIһ������Һ�滻ΪNaBr��Һ�����B����Һ�ʳȺ�ɫ����δ���Fe2+����1 C��ʢ�ŵ��Լ���_________������2�м���Fe2+���Լ���______��ѡ��NaBr��Һ��������______��
��4��ʵ��1��ּ��Ⱥ�����Ӧ�б�������δ����������Ԫ������֮��Ϊ1:2����A�з�����Ӧ�Ļ�ѧ����ʽΪ_______����β�������ķ�����_________��
��5����ѧϰС����Ϊʵ��1 ����Һ���������ܻ�������һ��ԭ���ǣ�________________________���������ʵ�鷽����֤�˲��룺_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com