
利用所学化学反应原理,解答以下问题:
(1) 某溶液含两种相同物质的量的溶质,其中只存在OH-、H+、NH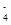 、Cl-四种离子,且c(NH
、Cl-四种离子,且c(NH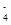 )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是________。
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是________。
(2) 已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是________________________________。
(3) 以石墨电极电解100 mL 0.1 mol·L-1 CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为______g。
(4) 向明矾溶液中逐渐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7(填“>”、“<”或“=”)离子反应总方程式为_______________________________________,向明矾溶液中逐渐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的pH 7(填“>”、“<”或“=”)离子反应总方程式为 。
(共12分)
(1) NH4Cl和NH3·H2O (2分) (2) R2Z>RX>RY(2分) (3) 0.64(2分)
(4) pH>7(1分) Al3++2SO42-+2Ba2++4OH— = AlO2-+2BaSO4↓+2H2O (2分)
pH ="7" (1分) 2Al3++3SO42—+3Ba2++6OH— = 2Al(OH)3↓+3BaSO4↓(2分)
解析试题分析:(1)如溶液为NH4Cl,则溶液中存在c(Cl-)>c(NH4+)>c(H+)>c(OH-),如溶液为NH3·H2O,则溶液中存在
c(NH4+)c(OH-)>c(H+),而c(NH4+)>c(Cl-)>c(OH-)>c(H+),则应为NH4Cl和 NH3·H2O的混合物,
故答案为:NH4Cl和 NH3·H2O。
(2)由Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12可知,
RX溶液中c(R+)= 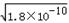 ,RY溶液中c(R+)=
,RY溶液中c(R+)= 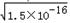 ,R2Z溶液中c(R+)=
,R2Z溶液中c(R+)= 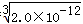 ,
,
则R+浓度由大到小的顺序是R2Z>RX>RY,
故答案为:R2Z>RX>RY。
(3)电解CuSO4溶液,阴极反应为:Cu2++2e-=Cu,阳极反应为:2H2O-4e-=4H++O2↑,
当Cu完全析出时,生成n(O2)=(1/2)×0.01mol=0.005mol,而此时在阳极生成0.01mol气体,则标明Cu完全析出,在阴极上还发生:2H++2e-=H2↑,所以生成的铜为m(Cu)=0.01mol×64g/mol=0.64g,
故答案为:0.64。
(4)碱过量,故溶液的pH>7。离子反应总方程式为Al3++2SO42-+2Ba2++4OH— = AlO2-+2BaSO4↓+2H2O。碱反应完,故pH =7,离子反应总方程式为2Al3++3SO42—+3Ba2++6OH— = 2Al(OH)3↓+3BaSO4↓。
考点:酸碱混合时的定性判断及有关ph的计算 化学平衡的计算 弱电解质在水溶液中的电离平衡 盐类水解的应用 难溶电解质的溶解平衡及沉淀转化的本质
点评:本题考查较为综合,涉及弱电解质的电离、盐类的水解、难溶电解质的溶解平衡、电化学以及化学平衡知识,题目难度较大,本题易错点为(6),注意从等效平衡的角度分析。


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
 (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题:| H | + 4 |
| H | + 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度(mol?L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、![]() 、Cl一四种离子,且c(
、Cl一四种离子,且c(![]() )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:______________________。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是_____________。
(4)以石墨电极电解100 mL 0.1 mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为__________g。
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=_______mol·L-1.

(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+I2(g)![]() 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:

下列说法正确的是_______________。
A.![]() +
+![]() =1 B.2
=1 B.2![]() =
=![]() C.a+b=14.9 D.c1=c2=c3
C.a+b=14.9 D.c1=c2=c3
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二下学期期中考试化学试卷(解析版) 题型:填空题
利用所学化学反应原理,解答以下问题:
(1) 某溶液含两种相同物质的量的溶质,其中只存在OH-、H+、NH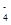 、Cl-四种离子,且c(NH
、Cl-四种离子,且c(NH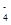 )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是________。
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是________。
(2) 已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是________________________________。
(3) 以石墨电极电解100 mL 0.1 mol·L-1 CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为______g。
(4) 向明矾溶液中逐渐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7(填“>”、“<”或“=”)离子反应总方程式为_______________________________________,向明矾溶液中逐渐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的pH 7(填“>”、“<”或“=”)离子反应总方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013届河南省郑州市高二上学期期末调研测试化学试卷(解析版) 题型:填空题
(10分) 利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,溶液中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),则这两种溶质是 _________ 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)以石墨电极电解100 mL 0.1 mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为 g。
(4)将AgCl分别放入①5mL H2O ②10mL0.2mol·L-1 MgCl2 ③20 mL0.5mol·L-1 NaCl溶液 ④40 mL0.1mol·L-1HCl中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是________________。
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(忽略溶液体积变化),则c(HCl)=_________mol·L-1。
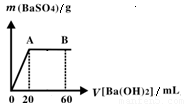
查看答案和解析>>
科目:高中化学 来源:2012届浙江省东阳市高三下学期期中考试化学试卷 题型:填空题
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.

(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g) 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A. +
+ =1
B.2
=1
B.2 =
= C.a+b=14.9
D.c1=c2=c3
C.a+b=14.9
D.c1=c2=c3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com