
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(![]() ),发生反应:
),发生反应:![]()
![]()
![]() ,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
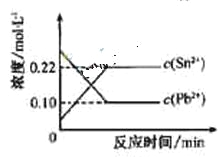
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量![]() 固体后,c(Sn2-)变小
固体后,c(Sn2-)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应![]()
D.25℃时,该反应的平衡常数K=2.2
科目:高中化学 来源: 题型:
【题目】如图中分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的两组装置,回答下列问题:
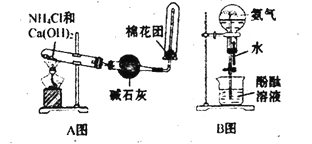
(1)用A图所示的装置可制备干燥的NH3,反应的化学方程式为:___。干燥管中干燥剂能否改用无水CaCl2?__。(填“能”或“不能”)检验NH3是否收集满的实验方法是:__。氨气溶于水呈碱性的原因是:___。
(2)若要配制100mL9.0mol/L的氨水,用到的玻璃仪器有烧杯、玻璃棒、量筒、___、__。
(3)将等浓度、等体积的氨水和盐酸混合,所得溶液中离子浓度从大到小的顺序为___。
(4)用B图所示的装置可进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是__,该实验的原理是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1mol O2 | 4molSO3 | 2molSO2、1mol O2 |
平衡v正(SO2)/ mol·L-1 ·s-1 | v1 | v2 | v3 |
平衡c(SO3)/ mol·L-1 | c1 | c2 | c3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(O2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是 ( )
A.v1<v2,c2<2c1B.K1>K3 ,p2>2p3
C.v1<v
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理;其主反应历程如图所示(H2→![]() H+
H+![]() H)。下列说法错误的是( )
H)。下列说法错误的是( )
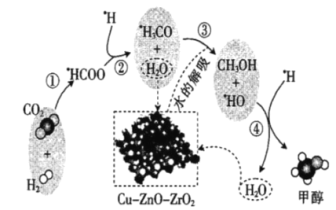
A.二氧化碳加氢制甲醇的过程中原子利用率达100%
B.带标记的物质是该反应历程中的中间产物
C.向该反应体系中加入少量的水能增加甲醇的收率
D.第③步的反应式为![]() H3CO+H2O→CH3OH+
H3CO+H2O→CH3OH+![]() HO
HO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1反应Ⅱ:N2H4(g)+H2(g)2NH3(g)ΔH2=-41.8 kJ·mol-1
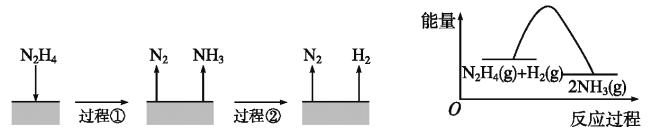
下列说法不正确的是()
A. 图所示过程①是放热反应
B. 反应Ⅱ的能量过程示意图如图所示
C. 断开3 mol N2H4(g)的化学键吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化学键释放的能量
D. 200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g)ΔH=+50.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染等行业。以硫化铜精矿为原料生产CuCl的工艺如图:
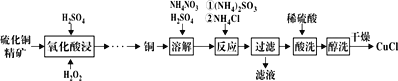
已知CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+Cl-![]() CuCl2-],潮湿空气中易水解氧化。
CuCl2-],潮湿空气中易水解氧化。
(1)“氧化酸浸”前先将铜矿粉碎的目的是__。该过程生成蓝色溶液和浅黄色沉淀,则反应的化学反应方程式为__;
(2)“溶解”时所用硫酸浓度为0.3mol·L-1,配制1L此硫酸溶液,需要98%、1.84g·mL-1浓硫酸__mL(保留1位小数)。溶解时反应的离子方程式__;
(3)“反应”时,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。
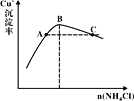
①反应的氧化产物是___,n(氧化剂):n(还原剂)=___;
②比较c(Cu+)相对大小:A点___C点(填“>”、“<”或“=”)。
③提高处于C点状态的混合物中Cu+沉淀率措施是___;
(4)“过滤”所得滤液中溶质主要成分的化学式为__;
(5)不能用硝酸代替硫酸进行“酸洗”,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】快离子导体是一类具有优良离子导电能力的固体电解质。图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。回答下列问题:
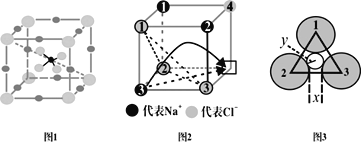
(1)S+2e-=S2-过程中,获得的电子填入基态S原子的___(填轨道符号);
(2)BF3+NH3=NH3BF3的反应过程中,形成化学键时提供电子的原子轨道符号是___;产物分子中采取sp3杂化轨道形成化学键的原子是___;
(3)基态Li+、B+分别失去一个电子时,需吸收更多能量的是___,理由是___;
(4)图1所示的晶体中,锂原子处于立方体的位置___;若其晶胞参数为apm,则晶胞密度为___g·cm-3(列出计算式即可)
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的![]() ,且氯化钠晶胞参数a=564pm。氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中。每一个空隙由___个Cl-构成,空隙的空间形状为___;
,且氯化钠晶胞参数a=564pm。氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中。每一个空隙由___个Cl-构成,空隙的空间形状为___;
(6)温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Na+)=95pm,r(Cl-)=185pm,![]() =1.4,
=1.4,![]() 。
。
①x=___,y=___;(保留一位小数)
②迁移可能性更大的途径是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
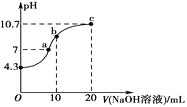
①写出H2N2O2在水溶液中的电离方程式:__。
②c点时溶液中各离子浓度由大到小的顺序为__。
③b点时溶液中c(H2N2O2)__c(N2O22-)。(填“>”“<”或“=”,下同)
④a点时溶液中c(Na+)__c(HN2O)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =__。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=__。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(3)有时我们将NaHCO3溶液中的平衡表示为:2HCO3-![]() H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理___(填序号)
H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理___(填序号)
A.适当浓度的盐酸
B.适当浓度Ba(OH)2溶液
C.适当浓度BaCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com