
【题目】根据以下反应:
KMnO4+ Na2SO3+ H2SO4= MnSO4+ Na2SO4+ K2SO4+ H2O
回答下列问题:
I.请配平该反应方程式___,该反应还原剂是___,还原产物是___。
II.当反应转移1mol电子时,被氧化的物质的质量为___g。
Ⅲ.用单线桥法标出反应中电子转移的方向和数目___。
【答案】2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+1K2SO4+3H2O Na2SO3 MnSO4 63 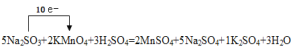
【解析】
I.KMnO4中锰元素化合价由+7降低为+2,KMnO4被还原为MnSO4,还原产物是MnSO4;Na2SO3中硫元素化合价由+4升高为+6,Na2SO3是还原剂;根据得失电子守恒、元素守恒,配平该反应方程式为2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+1K2SO4+3H2O。
II.Na2SO3中硫元素化合价由+4升高为+6,1mol Na2SO3被氧化,转移电子2mol,所以当反应转移1mol电子时,被氧化的Na2SO3物质的量为0.5mol,质量为0.5mol ×126g/mol=63g。
Ⅲ.用单线桥法标出反应中电子转移的方向和数目为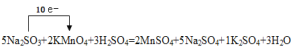 。
。


科目:高中化学 来源: 题型:
【题目】常温下,在474.8g水中溶解25.2g草酸晶体(H2C2O4·2H2O,相对分子质量为126),得到一份草酸浓溶液,该溶液密度为2.0g/cm3。
(1)以上过程得到的草酸浓溶液的物质的量浓度为___mol/L。
(2)现需用上述浓溶液配制0.1mol/L的草酸溶液450mL。
①实验中用到的玻璃仪器有胶头滴管、烧杯、量筒、___。
②应量取浓溶液的体积为___mL。
③下列情况中,会导致配制的0.1mol/L的草酸溶液浓度偏高的有___(填字母)。
A.配制浓溶液所使用的草酸晶体失去部分结晶水
B.使用“左码右物”的方法称量草酸晶体
C.容量瓶未经干燥就使用
D.量取浓溶液时仰视刻度线
(3)H2C2O4·2H2O受热易分解,分解产物均为氧化物,其中一种产物能使澄清石灰水变浑浊,请写出H2C2O4·2H2O受热分解的化学方程式___。
(4)用移液管量取10.00mL酸性K2Cr2O7溶液,恰好与20.00mL0.1mol/L的草酸溶液反应,还原产物为Cr3+,氧化产物为CO2。在此实验中,草酸体现___性;此酸性K2Cr2O7溶液的物质的量浓度为___mol/L(保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对C2H6和C5H12的分析错误的是( )
A. 互为同系物
B. C2H6失去1个H得到的乙基只有一种结构
C. C5H12的一氯代物可能只有一种
D. 2,2-二甲基丙烷的沸点高于其同分异构体的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),该反应的化学方程式为________;若反应中有0.3mol电子发生转移时,生成亚硝酸的质量为_______g (保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气的成分有多种,有机物E (C9H10O2)是其中的一种,它可以从茉莉花中提取,也可以用酒精和苯的某一同系物(C7H8)为原料进行人工合成,合成路线如下:
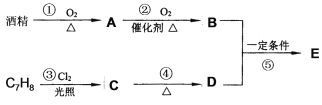
【1】C物质中官能团的名称是:___________。
【2】③的有机反应类型是:_______________。
【3】反应④发生还需要的试剂是:_____________。
【4】写出反应⑤的化学方程式:______________。
【5】证明反应②中A物质己完全转化为B物质的方法是:________________。
【6】E的同分异构体中,苯环上只有一个取代基,并包含一个酯基的结构有多个,下面是其中2个的结构简式:
![]() 、
、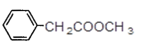
请再写出2个符合上述要求的E的同分异构体结构简式:______和__________
【7】请写出以CH2=CHCH2CH3为唯一有机原料制备CH2=CHCH=CH2的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.0l mol L -1 NaOH溶液滴入20mL0.01mol·L-1CH3COOH溶液的过程中,溶液中由水电离出的c(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是
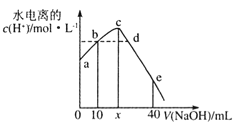
A. x=20,a点的纵坐标为1.0×10-12
B. b点和d点所示溶液的pH相等
C. 滴定过程中,c(CH3COO-)与c(OH-)的比值逐渐增大
D. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)用“双线桥法”标明反应中电子转移的方向和数目_________。
(2)该反应中,氧化剂和还原剂物质的量之比是_________。
(3)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式:_____KMnO4+H2SO4+H2C2O4 = MnSO4+K2SO4 +CO2↑+H2O。
Ⅱ.盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2 g/mL,质量分数为36.5%的浓盐酸配制250mL 3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为________mL。
(2)实验过程中,下列操作会导致最终所配溶液浓度偏高的是____________。
A.量取浓盐酸时俯视刻度线 B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线 D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( )
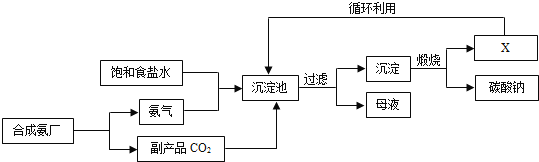
A.沉淀池中的反应物共含有五种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com