
【题目】用离子方程式回答下列问题:
(1)泡沫灭火器中灭火原理(内装小苏打溶液和![]() 溶液____________。
溶液____________。
(2)已知AgCl为难溶于水和酸的白色固体,![]() 为难溶于水和酸的黑色固体。向AgCl的悬浊液中加入足量的
为难溶于水和酸的黑色固体。向AgCl的悬浊液中加入足量的![]() 溶液并振荡,白色固体完全转化为黑色固体:________________。
溶液并振荡,白色固体完全转化为黑色固体:________________。
(3)③实验室配制![]() 溶液,溶解时先要加入少量的稀硫酸,其原因________;配制完毕后要加入少量铁屑,其目的是_____________。
溶液,溶解时先要加入少量的稀硫酸,其原因________;配制完毕后要加入少量铁屑,其目的是_____________。
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.钢铁发生电化学腐蚀时,正极上发生的反应为 Fe-2e-=Fe2+
B.用惰性电极分别电解熔融的NaCl和饱和食盐水时,阳极的电极反应式均为:2Cl- -2e-=Cl2↑
C.铜锌原电池工作时,若有13 克锌被溶解,外电路就有0.2 mol电子通过
D.电解精炼铜时,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气,所用下列装置、药品等正确的是
A.①是氨气发生装置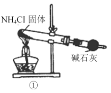 B.②是氨气发生装置
B.②是氨气发生装置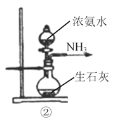
C.③是氨气收集、检验装置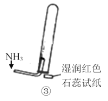 D.④是氨气吸收装置
D.④是氨气吸收装置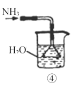
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ物质的类别和核心元素的化合价是研究物质性质的两个重要角度。
下图所示是硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
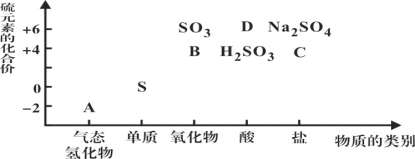
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊溶液的现象是__________________________;用一个化学方程式说明B具有还原性_____________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为__________(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)将A与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为_____。
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________________________,反应中D显示酸性和______________。
Ⅱ.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?
请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸使木条变黑__________
②热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。
可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。请回答下列问题:
配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
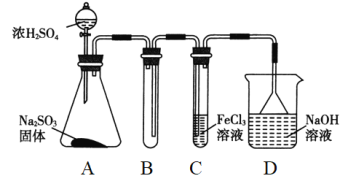
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异形体
B. H2S的电子式可表示为![]()
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -116 |
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式____;
在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是___(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层,若产物中有少量未反应的Br2,最好用____洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)若产物中有少量副产物乙醚。可用____的方法除去,加热方式为____。
(5)反应过程中应用___冷却装置D
A.冰水混合物 B.室温下的水 C.60℃ D.100℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
B. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com