
【题目】某同学实验室用下列装置探究氯气的性质。
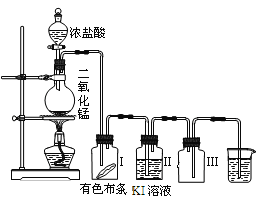
(1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并判断电子得失数目__;__。
(2)实验时发现有色布条__,其原因是__;
(3)烧杯中溶液的作用是__;广口瓶Ⅲ的作用是__。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2e- 褪色 湿润的氯气可以使得有色布条褪色 吸收尾气,防止污染环境 收集气体
MnCl2+Cl2↑+2H2O 2e- 褪色 湿润的氯气可以使得有色布条褪色 吸收尾气,防止污染环境 收集气体
【解析】
(1)结合守恒法写出发生反应的化学方程式,由元素化合价的变化判断反应中转移的电子数目;
(2)氯气无漂白性,制备的氯气中含有水蒸气,氯气与水反应生成HClO;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ可收集气体。
(1)二氧化锰和浓盐酸反应得氯气,同时生成二氯化锰和水,则发生反应的化学方程式为MnO2+4HCl═MnCl2+Cl2+2H2O,在反应中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,;
(2)氯气无漂白性,制备的氯气中含有水蒸气,氯气与水反应生成的HClO有漂白性,则遇到有色布条会褪色;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ的作用是收集氯气。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
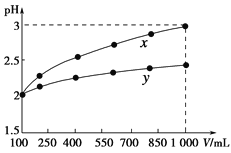
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
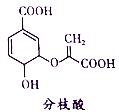
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Rozerem用于治疗难以入睡型失眠症,是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法不正确的是( )
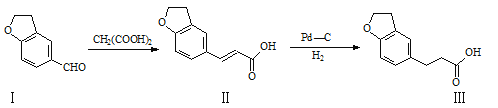
A.化合物Ⅰ、Ⅱ均能使酸性KMnO4溶液褪色
B.Ⅱ→Ⅲ的反应为加成反应
C.1mol化合物Ⅱ最多能与5molH2发生加成反应
D.与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述的方法中,能将有机化合物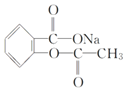 转变为
转变为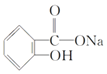 的有( )
的有( )
A.跟足量的NaOH溶液共热后,再通入二氧化碳直至过量
B.把溶液充分加热后,通入足量的二氧化硫
C.与稀H2SO4共热后,加入足量NaOH溶液
D.与稀H2SO4共热后,加入足量NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应表达正确的是
A.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
B.服用阿司匹林过量出现水杨酸(![]() )中毒反应,可静脉注射NaHCO3溶液:
)中毒反应,可静脉注射NaHCO3溶液:![]() + 2 HCO3- →
+ 2 HCO3- →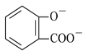 + 2CO2↑ + 2H2O
+ 2CO2↑ + 2H2O
C.乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+ NH4++2Ag↓+3NH3↑ +H2O
CH3COO-+ NH4++2Ag↓+3NH3↑ +H2O
D.苯酚钠溶液中通入少量CO2: CO2+H2O+2C6H5O- → 2C6H5OH+2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是接触法生产硫酸中常用的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
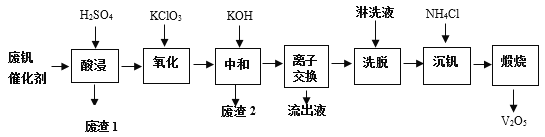
回答下列问题:
(1)提高“酸浸”效率的措施:________________;________________(写两条)。“废渣1”的主要成分是__________________________。
(2)“氧化”中主要是将VO2+变为VO2+,则氧化剂与还原剂之比为________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有__________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH + V4O124- ![]() R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com