
【题目】五氧化二钒(V2O5)是接触法生产硫酸中常用的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
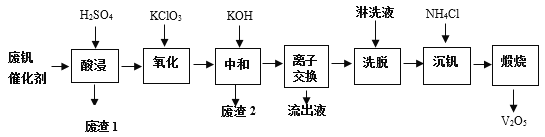
回答下列问题:
(1)提高“酸浸”效率的措施:________________;________________(写两条)。“废渣1”的主要成分是__________________________。
(2)“氧化”中主要是将VO2+变为VO2+,则氧化剂与还原剂之比为________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有__________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH + V4O124- ![]() R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
R4V4O12 + 4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______性(填“酸”“碱”“中”)。“流出液”中阳离子最多的是______________。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式______。
【答案】升高温度 将废钒催化剂粉碎 SiO2 1:6 Fe(OH)3、Al(OH)3 碱 K+ 2NH4VO3![]() V2O5 + H2O↑ + 2NH3↑
V2O5 + H2O↑ + 2NH3↑
【解析】
从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,“离子交换”和“洗脱”可简单表示为:4ROH + V4O124- ![]() R4V4O12 + 4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此来解答。
R4V4O12 + 4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此来解答。
(1)提高酸浸常用方法为将将废钒催化剂粉碎或者提高温度等;废渣1主要是不溶于酸的二氧化硅,
故答案为:升高温度;将废钒催化剂粉碎;SiO2;
(2)氧化”中氧化剂为KClO3,Cl元素由+5降到-1价,降低6价,还原剂为VO2+,V元素由+4价升高到+5价,降低1价,根据电子守恒可知答案为:1:6;
(3)由上述流出分析可知滤渣2为Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)利用强碱性阴离子交换树脂可“离子交换”和“洗脱”,则应选择碱性条件下使用,且OH-浓度大反应逆向移动提高洗脱效率;由上述分析可知,流出液中主要为硫酸钾,则“流出液”中阳离子最多的是K+,
故答案为:碱;K+;
(5) “煅烧”中发生反应的化学方程式为2NH4VO3![]() V2O5 + H2O↑ + 2NH3↑,故答案为2NH4VO3
V2O5 + H2O↑ + 2NH3↑,故答案为2NH4VO3![]() V2O5 + H2O↑ + 2NH3↑;
V2O5 + H2O↑ + 2NH3↑;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】mg铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加amol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值ng,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为![]() mol
mol
④生成NO气体的体积室温下为![]() L
L
⑤与合金反应的硝酸的物质的量为(![]() )mol
)mol
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学实验室用下列装置探究氯气的性质。
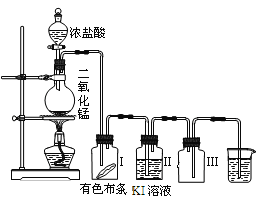
(1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并判断电子得失数目__;__。
(2)实验时发现有色布条__,其原因是__;
(3)烧杯中溶液的作用是__;广口瓶Ⅲ的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于隐形眼镜材料的聚合物片段如下:

下列关于该高分子说法正确的是
A. 结构简式为:
B. 氢键对该高分子的性能没有影响
C. 完全水解得到的高分子有机物,含有官能团羧基和碳碳双键
D. 完全水解得到的小分子有机物,具有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
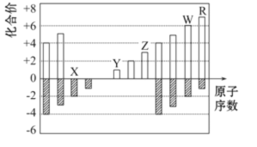
A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是芳香族化合物,其分子式为C9H11Cl,利用A合成2-甲基苯乙酸,其合成路线如下:
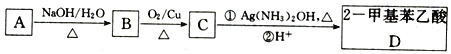
(1)A结构简式为_____________。
(2)A→B反应类型为_______;C中所含官能团的名称为______________。
(3)C→D第①步的化学方程式为____________。
(4)在NaOH醇溶液并加热的条件下,A转化为E,符合下列条件的E的同分异构体有___种,任写其中一种的结构简式____________。
i,苯环上仅有一个取代基;ii.能与溴水发生加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物G是一种可用于治疗肿瘤的药物,实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)B的结构简式为______________; C的化学名称是______________。
(2)③的反应试剂和反应条件分别是___________________,该反应的类型是__________。
(3)⑤的反应方程式为____________________。
(4)G的分子式为_____________________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。 ___________________
)制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。 ___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、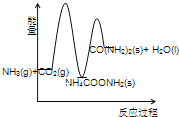 B、
B、
C、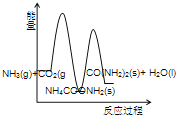 D、
D、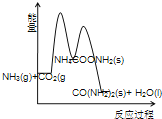
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
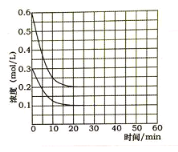
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com