
【题目】取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是( )
A.C2H2 C2H6
B.CH4 C3H8
C.C3H6 C3H8
D.C2H4 C4H8
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温下,含1molFe的铁片与过量浓HNO3反应,转移电子的数目为3NA个
B.电解饱和食盐水,当阴极产生2.24LH2时,转移的电子数为0.2NA
C.标准状况下,33.6LSO3含有9.03 x1023个SO3分子
D.在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,所用仪器合理的是
A. 在坩埚中放入NaCl溶液,加热、蒸发得到NaCl晶体
B. 用10 mL的量筒量取5.2 mL的盐酸
C. 用托盘天平称取25.20 g NaCl
D. 用1 000 mL容量瓶配制450 mL 0.1 mol·L-1的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是
A. 将40 g NaOH溶解在1 L水中
B. 将22.4 L HCl气体溶于水配成1 L溶液
C. 将1 L 10 mol/L浓盐酸加入9 L水中
D. 将10 g NaOH溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块表面氧化成氧化钠的金属钠,总质量为5.22 g,投入到94.88 g水(足量)中,待充分反应后收集到氢气0.2 g,求:
(1)其中含氧化钠的质量是多少克?
(2)反应后所得氢氧化钠溶液的质量分数是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宣传科学知识,介绍高新科技,推广高新技术,揭露伪科学,是科学工作者和当代中学生的义务。下列说法中不属于伪科学的是( )
A.没有水就没有生命
B.这种饮料中不含任何化学物质
C.这种口服液中含丰富的氮、磷、镁等微量元素
D.这种环保汽车不消耗任何能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
海藻![]() 海藻灰
海藻灰![]() 海藻灰悬浊液
海藻灰悬浊液![]()

(1)写出提取碘的过程中有关实验操作的名称:①______;③________。
(2)提取碘的过程中可供选择的有机溶剂是( )
A.汽油、酒精 B.四氯化碳、汽油 C.醋酸、酒精
(3)为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是____________________________________。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处:①______,②________,③________,④________。

(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN﹣氧化的反应).
【相关资料】
①氰化物主要是以CN﹣和[Fe(CN)6]3﹣两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3﹣较CN﹣难被双氧水氧化,且pH越大,[Fe(CN)6]3﹣越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
实验 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | 7 | 60 | 10 |
(2)实验测得含氰废水中的总氰浓度(以CN﹣表示)随时间变化关系如图所示.
实验①中20~60min时间段反应速率:υ(CN﹣)= molL﹣1min﹣1 .
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是 (填一点即可).在偏碱性条件下,含氰废水中的CN﹣最终被双氧水氧化为HCO3﹣ , 同时放出NH3 , 试写出该反应的离子方程式: .
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN﹣浓度可用离子色谱仪测定)
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对金属制品进行抗腐蚀处理,可延长其使用寿命。
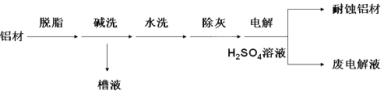
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是____________
_(用离子方程式表示)。为将碱洗槽液中的铝以沉淀的形式回收,最好向槽液中加入下列试剂中的________。
a. NH3 b.CO2
c. NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为____________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com