
【题目】恒温恒容下,将2 mol A气体和4 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min达平衡,测得平衡时A为1.2 mol ,C的浓度为0.8 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变
D.A的消耗速率与B的消耗速率之比为2:1
【答案】 0.4 mol/(L·min) 4 4:1 ABC
【解析】由题意得: 2A(g)+B(g) xC(g)+2D(s)
初始量(mol·L-1) 1 2 0 0
变化量(mol·L-1) 0.4 0.2 0.8 0,4
平衡量 (mol·L-1) 0.6 1.8 0.8 0.4
(1)从开始反应至达到平衡状态,生成C的平均反应速率为v=c/![]() t=0.8 mol·L-1/2 min= 0.4 mol/(L·min);答案:0.4 mol/(L·min)。
t=0.8 mol·L-1/2 min= 0.4 mol/(L·min);答案:0.4 mol/(L·min)。
(2) 根据上述浓度变化的比例关系得x=4
(3)因为转化率为变化量比初始量。A的转化率= 0.4mol·L-1/1 mol·L-1![]() 100
100![]() =40
=40![]() ; B的转化率=0.2mol·L-1/2 mol·L-1
; B的转化率=0.2mol·L-1/2 mol·L-1![]() 100
100![]() =10
=10![]() ,所以A的转化率与B的转化率之比为40
,所以A的转化率与B的转化率之比为40![]() :10
:10![]() =4:1;答案:4:1。
=4:1;答案:4:1。
(4)A.该反应在密闭容器中进行,反应前后气体分子数不同,所以压强不变可以作为判断平衡的依据,故A正确;B.该反应前后气体体积是改变的反应,正反应进行过程中,由于产生了固体,气体的质量减小,所以正反应的气体的密度减小,当气体密度不变时可说明反应达到平衡状态,故选B项;
C.该反应是前后气体的分子数不同的反应,正反应气体的质量减小,所以正反应气体的平均相对分子质量减小,当气体的平均相对分子质量不变时,可说明反应达到平衡状态,故选C项;D.A的消耗速率与B的消耗速率之比始终是2:1,所以不能作为平衡的判据,故D错误。


科目:高中化学 来源: 题型:
【题目】H3BO3(一元弱酸) 可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
D. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO![]() 被还原为NO),最终溶液体积为1L。下列说法正确的是( )
被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A. 反应后生成NO的体积为33.6 L (标况)
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶2
C. 所得溶液中c(NO![]() )=2.75 mol·L-1
)=2.75 mol·L-1
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1981年,Thoms Cech在研究四膜虫时,发现其rRNA前体加工除去某些片段的过程中发生“剪接反应”,该反应是在仅有RNA没有任何蛋白质参与的情况下完成的。下列推论最合理的是( )
A.该反应不需要酶的催化 B.四膜虫体内的这种RNA具有酶的特性
C.所有蛋白质和RNA都是酶 D.有的DNA也可能是酶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 2H2 (g)+O2 (g)=2H2O(l) △H= a kJ/mol,2H2 (g)+O2 (g)=2H2O(g) △H= b kJ/mol,则a、b的大小关系是
A.a=bB.a>bC.a<bD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2﹣CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( ) 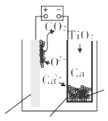
A.由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子
B.阳极的电极反应式为 C+2O2﹣﹣4e﹣═CO2↑
C.在制备金属钛前后,整套装置中 CaO 的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com