
【题目】H3BO3(一元弱酸) 可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
D. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
【答案】C
【解析】A 、左边石墨电极为电解池的阳极,M室中的H2O失去电子生成氧气,电极方程式为:2H2O-4e-= O2↑+4H+,A正确;B、右边石墨电极为阴极,水中的H+得到电子生成H2,溶液中的OH-浓度增大,原料室中的Na+通过c膜移向N室,所以N室中NaOH的浓度增大,故N室中:a% <b%,B正确;C、M室中生成的H+通过a膜进入产品室,原料室中的B(OH)4-通过b膜进入产品室,发生反应:H++ B(OH)4-=H3BO3+H2O。生成1mol H3BO3,需要从M室中产生1molH+,则电路中转移的电子为1mol,阴极室产生的是H2,根据电子守恒可知阴极室产生的H2的物质的量为0.5mol,其在标准状况下的体积为11.2L,C错误;D、M室中产生的H+通过a膜进入产品室,a膜为阳膜,原料室中的B(OH)4-通过b膜进入产品室,b膜为阴膜,两者在产品室发生反应:H++ B(OH)4-=H3BO3+H2O,反应的原理为强酸制取弱酸,D正确。正确答案为C。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
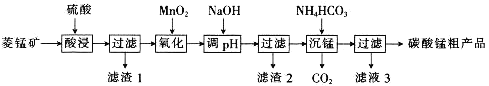
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
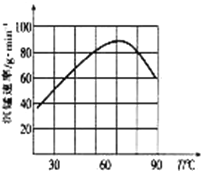
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明微量元素是生命活动所必需的是下列哪项( )
A. Mg是叶绿素的组成成分
B. 哺乳动物血液中Ca2+含量太低,会抽搐
C. 油菜缺少B时只会开花不结果
D. Ca2+缺少时,会影响骨髓的发育
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生理盐水是指质量分数为0.9%的NaCl溶液.下列有关该溶液说法正确的是( )
A.100g溶液中含有0.9 g NaCl
B.100 g水中含有0.9 g NaCl
C.100 g溶液中含有0.9 mol NaCl
D.100 g水中含有0.9 mol NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年巴黎气候变化大会规定:本世纪实现温室气体净零排放.下列物质燃烧时能实现二氧化碳零排放的是( )
A.天然气
B.氢气
C.水煤气
D.煤炭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.用完的电池可以随意丢弃
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.把煤粉碎了再燃烧可以提高煤的燃烧效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2 mol A气体和4 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min达平衡,测得平衡时A为1.2 mol ,C的浓度为0.8 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变
D.A的消耗速率与B的消耗速率之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com