
【题目】A、B、C、D四种物质之间的转化关系如图所示(部分产物已略去),下列说法正确的是( )

A. 若A为AlCl3溶液,B可能为氨水,反应①的离子方程式为:A13++4NH3·H2O=AlO2+ 4NH4++2H2O
B. 若A为Fe,B可能为稀硝酸,反应②的离子方程式为: 3Fe+8H++2NO3=3Fe2++2NO↑+4H2O
C. 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴别C、D溶液
D. 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3
【答案】B
【解析】A. 氯化铝与氨水反应,与氨水的量的多少无关,过量的氨水不能溶解生成的氢氧化铝沉淀,故A错误;B. 铁与稀硝酸反应与量有关,硝酸过量,将铁氧化为铁离子,硝酸不足,反应生成亚铁离子,若A为Fe,B可能为稀HNO3,此时反应②的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故B正确;C. 若A为NaOH溶液,B可能为CO2,C为碳酸氢钠,D为碳酸钠,二者与Ca(OH)2溶液均生成白色沉淀,无法区分,故C错误;D. 若A为Cl2,B为NH3,则C为氯化铵,D为氯化氢,加热固体氯化铵分解生成氨气和氯化氢,氨气和氯化氢又化合生成氯化铵,不能用来制取NH3,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 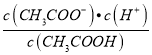
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
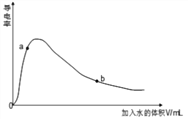
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R是原子序数依次增大的短周期主族元素,X在周期表中原子半径最小,Y与Z相邻,Z、R在地壳中的含量位列前两位,M为短周期中电负性最小的元素。请回答:
(1)基态Z原子的外围电子排布图为____________。
(2)X与Y能形成多种化合物,其中Y2X2分子中σ键、π键的数目之比为_______。
(3)在R3Y4晶体中键角:Y-R-Y____R-Y-R(填“>”“<”或“=”),原因为________。
(4)钨(W)元素可以和Z、M形成多种化合物,其中一种化合物的晶体结构如图:

已知:相邻Z原子的核间距为apm,钨原子位于Z原子形成的正八面体的体心,M离子位于钨原子形成的立方体的体心。
①与M原子距离最近且相等的Z原子的数目为_________。
②晶体的化学式为__________。
③设NA为阿伏加德罗常数的值,则晶体的密度为______g/cm3(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素。A是形成化合物种类最多的元素;B原子基态电子排布中只有一个未成对电子;C是同周期元素中原子半径最小的元素;D的基态原子在前四周期元素的基态原子中单电 子数最多;E与D相邻,E的某种氧化物X与C的氢化物的浓溶液加热时反应常用于实验室制取气态单质C;F与D的最外层电子数相等。回答下列问题(相关回答均用元素符号表示):
(1)D元素在元素周期表的位置是__________________。
(2)A2H2分子中A原子轨道的杂化类型为_______,lmol A2H2含有δ键的数目为_____,B2通入稀NaOH溶液中可生成OB2,OB2分子构型为_____________。
(3)将F单质的粉末加人NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离
子方程式是______________________。
(4)X在制取C单质中的作用是______________,C的某种含氧酸盐常用于实验室制制取氧气,此酸根离子中化学键的键角_______(填“>”“=” 或“<”)109°28。
(5)已知F与C的某种化合物的晶胞结构如图所示,则该化合物的化学式是_________,若F与C原子最近的距离为acm,则该晶体的密度为_______g ㎝-3(只要求列算式,不必计算出数字,阿伏伽徳罗常数的数值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氮化铝(AlN)溶于强酸产生铝盐,溶于强碱生成氨气。
(1)AlN与NaOH溶液反应的化学方程为_______。
(2)甲同学通过测定AlN与NaOH溶液反应产生氨气的质量来测定AlN的纯度(假设杂质不参与反应,忽略NH3在强碱性溶液中的溶解)。实验装置如下:

①选择上图中合适的装置,其连接顺序为______(按气流从左到右方向,填字母)。
②装置A中干燥管的作用是________。
(3)乙同学通过测定氨气体积来测定AlN的纯度。

①导管a的作用是________。
②读数前,需要进行的操作是_______。
③若称取样品的质量为mg,量气管中测定的气体体积为VmL,该实验条件下的气体摩尔体积为VmL/mol,则AlN的质量分数为______;若读取量气管中气体的体积时,液面左高右低,则测得的AlN的纯度______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C4H8O2,下列有关其同分异构体数目的说法中正确的是( )
A. 属于酯类的有4种
B. 属于羧酸的有3种
C. 既含有羟基又含有醛基的有3种
D. 不可能存在分子中含有六元环的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
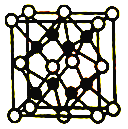
【题目】X、Y、Z、W、R五种前四周期元素,原子序数依次增大,其中X原基态时最外层电子数是其内层电子总数的2倍,Z原子基态时s电子数与p电子数相等,Z2-和W+有相同的核外电子排布;R的原子序数为29。回答下列问题:
(1)Y、Z、W三种元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)若M分子是Y2Z的等电子体,M的结构式为______, M分子的中心原子的轨道杂化类型为________, 1molM中含有_____molσ键。
(3)Y的简单氢化物极易溶于Z的简单氢化物中,其主要原因是_____________。
(4)基态R+离子的核外电子排布式是__________,R的高价离子与Y的最常见氢化物形成的配离子的化学式为________________。
(5)Z与W形成的化合物W2Z的晶胞如图。其中Z离子的配位数为________,与一个Z离子距离最近的所有W离子为顶点构成的几何体为________结构。若W2Z的晶胞边长为a pm,则该化合物的密度为_______g·cm-3(列出计算式即可,阿伏伽德罗常数用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com