
����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HC1O |
����ƽ�ⳣ�� | 1.7��10-5 | K1=4.3��10 K2=5.6��10-11 | 3.0��10-8 |
��ش��������⣺
��1��CH3COOH��H2CO3��HC1O��������ǿ������˳��Ϊ______________________��
��2��д��H2CO3�ĵ��뷽��ʽ��______________________��
��3��������0.1 mol��L-1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����______________________������ĸ��ţ���ͬ����
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)��c(OH-) D. 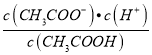
������Һ���{�¶ȣ�����4�ֱ���ʽ�������������_________________________��
��4��ȡ0.10mol CH3COOH �������ᣩ��������ʵ�飬����䵼����������ˮ���仯��ͼ��ʾ���Ƚ�a��b���������ʣ��>����<����=������
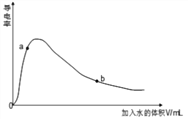
n(H+)��a_____b��c(CH3COO-)��a_____b����ȫ�к�ʱ����NaOH�����ʵ�����a_____b��
��5��H+Ũ����ͬ�������������ҺA(���ᣩ��B(CH3COOH)�քe��п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ�� ������˵����ȷ����__________����д��ţ�
�ٷ�Ӧ����Ҫ��ʱ��B>A �ڿ�ʼ��Ӧʱ������A>B
�۲μӷ�Ӧ��п�����ʵ���A=B ��A����пʣ��
���𰸡� CH3COOH>H2CO3>HC1O H2CO3![]() HCO3-+H+ A ABCD < > = �ۢ�
HCO3-+H+ A ABCD < > = �ۢ�
����������1�������̶�Խ��������ͬ�¶��µĵ���ƽ�ⳣ����Խ���ݱ������ݿ�֪����ƽ�ⳣ��CH3COOH��H2CO3��HClO���������ԣ�CH3COOH��H2CO3��HClO����2��̼���Ƕ�Ԫ���ᣬ���뷽��ʽΪH2CO3![]() HCO3-+H+����3���ڳ����£���������Һ�д��ڵ���ƽ�⣺CH3COOH
HCO3-+H+����3���ڳ����£���������Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO-+H+��A��ϡ�ʹٽ����룬�����ӵ����ʵ������ӣ���������Ũ�ȼ�С��A��ȷ��B����Һ�ڼ�ˮϡ�����У�c(CH3COOH)��c(H+)����ϡ�Ͷ���С�����д�������ʵ�����С�������ӵ����ʵ������ӣ�������Һ��
CH3COO-+H+��A��ϡ�ʹٽ����룬�����ӵ����ʵ������ӣ���������Ũ�ȼ�С��A��ȷ��B����Һ�ڼ�ˮϡ�����У�c(CH3COOH)��c(H+)����ϡ�Ͷ���С�����д�������ʵ�����С�������ӵ����ʵ������ӣ�������Һ��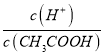 ���ߣ� B����C���¶Ȳ��䣬ˮ�����ӻ��������䣬C����D��
���ߣ� B����C���¶Ȳ��䣬ˮ�����ӻ��������䣬C����D��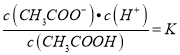 ���¶Ȳ��䣬���볣�����䣬D����ѡA������Һ���{�¶ȣ��ٽ����룬���볣��������Һ��������Ũ��������Ũ�ȼ�С����
���¶Ȳ��䣬���볣�����䣬D����ѡA������Һ���{�¶ȣ��ٽ����룬���볣��������Һ��������Ũ��������Ũ�ȼ�С���� ���������¶�ˮ�����ӻ���������ѡABCD����4��ϡ�ʹٽ����룬��n(H+)��a��b������Ũ��Խ������Խǿ����c(CH3COO-)��a��b��a��b�����������ʵ�����ȣ������ȫ�к�ʱ����NaOH�����ʵ�����a��b����5��������Ũ����ͬ�ĵ������A��B������Һ��AΪ���ᣬBΪ���ᣩ�ֱ���п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�������������ͬ�����ڴ��Ჿ�ֵ��룬�����Ũ�ȴ���������Ũ�ȣ�������HCl��Ũ�ȵ��������ӵ�Ũ�ȣ����Դ����Ũ�ȴ���HCl��Ũ�ȣ���������п��ʣ�ࣻ�����ڴ��������������Ӧ�Ͽ죬���Է�Ӧ�����ʱ��A��B�����ڿ�ʼpH��ͬ����������Ũ����ͬ�����Կ�ʼʱ��Ӧ����A=B�������������ɵ����������ͬ�����Բμӷ�Ӧ��п�����ʵ���A=B����ȷ���ܴ����Ũ�ȴ��������Ũ�ȣ�������ʣ�࣬����������п��ʣ�࣬��ȷ����ѡ�ۢ���
���������¶�ˮ�����ӻ���������ѡABCD����4��ϡ�ʹٽ����룬��n(H+)��a��b������Ũ��Խ������Խǿ����c(CH3COO-)��a��b��a��b�����������ʵ�����ȣ������ȫ�к�ʱ����NaOH�����ʵ�����a��b����5��������Ũ����ͬ�ĵ������A��B������Һ��AΪ���ᣬBΪ���ᣩ�ֱ���п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�������������ͬ�����ڴ��Ჿ�ֵ��룬�����Ũ�ȴ���������Ũ�ȣ�������HCl��Ũ�ȵ��������ӵ�Ũ�ȣ����Դ����Ũ�ȴ���HCl��Ũ�ȣ���������п��ʣ�ࣻ�����ڴ��������������Ӧ�Ͽ죬���Է�Ӧ�����ʱ��A��B�����ڿ�ʼpH��ͬ����������Ũ����ͬ�����Կ�ʼʱ��Ӧ����A=B�������������ɵ����������ͬ�����Բμӷ�Ӧ��п�����ʵ���A=B����ȷ���ܴ����Ũ�ȴ��������Ũ�ȣ�������ʣ�࣬����������п��ʣ�࣬��ȷ����ѡ�ۢ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���̼��(H2CO3)����(H2SiO3)��˵���в���ȷ����( )
A. ���߾�Ϊ����
B. ���߾���ʹ��ɫʯ����Һ���ɫ
C. CO2����ͨ��Na2SiO3��Һ�п����Ƶù���
D. ��������ʱ�����Էֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgSO4����A12(SO4)3�Ļ����Һ�У���μ���NaOH��Һ������ͼ��������ȷ��ʾ������Ӧ����(�������ʾ����NaOH��Һ��������������ʾ��Ӧ���ɳ���������)
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��a��b��c��Ϊ�ǽ������ʣ�d��e��Ϊ����10�����ӵĹ��ۻ�����ҷ���������ԭ�Ӹ�����d>e��fΪ���ӻ����������˵���������

A. �����£�����a����̬ B. ����c��ˮ��Һ����Ư����
C. �ȶ��ԣ�d< e D. f�����ֽ�Ϊd��e
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������;�㷺����ش�
I.�����������£������е�NH4+���ձ�O2����ΪNO3-���÷�Ӧ�����ӷ���ʽΪ________��
��.��������Ҫ�Ļ���ԭ�ϡ���֪��25��ʱ��NH3��H2O�ĵ��볣��kb=1.79��10-5�����¶��£�1.79mol/LNH4Cl��Һ��pHԼΪ_____________��
��.��������ʻ�����������·�Ӧ������
��.N2(g)+O2(g)![]() 2NO(g) ��H=+180.7kJ/mol
2NO(g) ��H=+180.7kJ/mol
��.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5kJ/mol
N2(g)+2CO2(g) ��H=-746.5kJ/mol
��1���ܱ�ʾCOȼ���ȵ��Ȼ�ѧ����ʽΪ__________________��
��2����Ӧ����________����ϸߡ��ϵ͡����¶������Է����С�
��3��T�¶�ʱ����10L�����ܱ������г���2molNO��2molCO������Ӧii��5minʱ�ﵽƽ�⣬���0��5min�ڸ÷�Ӧ����v(N2)=0.016mol��L-1��min-1��
��T�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=____________________��
��ƽ��ʱ������ѹǿ����ʼʱ������ѹǿ֮��Ϊ_________________��
��4��һ�������£�����ʼ�ݻ�Ϊ5L�ĺ�ѹ�ܱ���������1molN2��1molO2������Ӧi��O2��ƽ��ת����(��)���¶�(T)�Ĺ�ϵ��ͼ1��ʾ������Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��
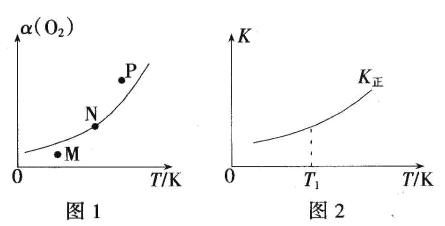
��ͼ1�У�M��N��P��������Ӧ��״̬�£�v(��)>v(��)����_______(����ĸ)������Ϊ______��
��T1�¶�ʱ��K��=1����O2��ƽ��ת����Ϊ________(������λ��Ч����)����ͼ2�л����淴Ӧƽ�ⳣ����K�������¶�(T)�Ĺ�ϵ���ߡ�________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ��ͬ���ʵ����������л���ֱ�������������ȼ�գ������������ٵģ� ��
A. ����B. ��ϩC. ��ȩD. �Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1���������ŵIJ�ͬ�����Զ��л�����з��࣬��ָ�������л�������࣬���ں����ϡ�
�� ![]() __________�� ��
__________�� �� ![]() ___________��
___________��
��![]() ____________ ����
____________ ����![]() ��
��
��![]() ___________��
___________��
��2��ij��A 0.2 mol�������г��ȼ�պ����ɻ�����B��C��1 mol��
����A�ķ���ʽΪ ��
������A����ʹ��ˮ��ɫ������һ�������£�����Cl2����ȡ����Ӧ����һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ ��
������A��ʹ��ˮ��ɫ���ڴ�����������H2�ӳɣ���ӳɲ�������к���3��������A���ܵĽṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ��������˵����ȷ���ǣ� ��

A. ��AΪAlCl3��Һ��B����Ϊ��ˮ����Ӧ�ٵ����ӷ���ʽΪ��A13++4NH3��H2O=AlO2+ 4NH4++2H2O
B. ��AΪFe��B����Ϊϡ���ᣬ��Ӧ�ڵ����ӷ���ʽΪ: 3Fe+8H++2NO3=3Fe2++2NO��+4H2O
C. ��AΪNaOH��Һ��B����ΪCO2������Ca(OH)2��Һ����C��D��Һ
D. ��AΪCl2��B����ΪNH3��ʵ���ҿ��ü��ȹ���C�ķ�����ȡNH3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com