
【题目】下列关于碳酸(H2CO3)和硅酸(H2SiO3)的说法中不正确的是( )
A. 两者均为弱酸
B. 两者均可使紫色石蕊试液变红色
C. CO2气体通入Na2SiO3溶液中可以制得硅酸
D. 两者受热时均可以分解
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨的合成是人类科学技术上的一项重大突破。其原理如下:
N2( g) +3H2( g) ![]() 2NH3( g) △H= -92.4kJ/mol
2NH3( g) △H= -92.4kJ/mol
据此回答下列与NH3有关的问题:
(1)该反应的化学平衡常数表达式为K =_________ 。
(2)①500℃时,若把10molN2与20molH2置于体积为10L的密闭容器内,测得容器内压强随时间的变化关系如下表:
压强/MPa | 9.6 | 8.4 | 7.6 | 7.0 | 6.4 | 6.4 | 6.4 | 6.4 |
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
则从反应开始到平衡这段时间内,v(H2)=_________mol/(L·min)。若达到平衡后,再充人5mol N2与10molH2,再次达到平衡时NH3的体积分数与原平衡状态相比_____(填“增大”“减小”或“不变”)。
②合成氨反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_____(填“A”或“B”);比较p1、p2的大小关系:_____________。

③某温度下,在恒压的某密闭容器中投入等物质的量的N2和H2,一段时间后测得H2的体积分数为40%,之后保持不变,则达到平衡时H2的转化率为________________。
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料,与水在一定条件下可以生成氨气:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的
2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的
是______(填序号)。
a.从反应开始到达到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中再加入少量CO(NH2)2,平衡正向移动
c.降低温度使尿素的转化率减小
d.恒温恒容时,向平衡体系中再充人少量氨气,平衡常数减小
(4)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb=_____________。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是 ( )
标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 碳酸钙与稀盐酸反应:2H++CO![]() ===CO2↑+H2O
===CO2↑+H2O
B. 氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
C. 氢氧化钡溶液与稀醋酸反应:H++OH-===H2O
D. 氯化铁溶液与铜反应:2Fe3++Cu===2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、材料是人类赖以生存和发展的重要物质基础。
(1)钢筋混凝土是重要的建筑材料,钢筋混凝土______ (填“是”或“不是”)复合材料。
(2)有机玻璃受热时会软化,易于加工成型。有机玻璃是一种_________材料(选填“硅酸盐”或“纤维”或“塑料”)。
Ⅱ.(1)我国汉代器物和秦俑彩绘用的颜料“汉紫”,直到近来人们才研究出来,其成分为紫色的硅酸铜钡(铜为+2价),它的化学式为:BaCuSi2Ox,则x的值为 _________
(2)我国新修订的《环境保护法》,使环境保护有了更严格的法律依据。
①北京和张家口市已成功申办2022年冬奥会,目前北京市政府正在全力改善空气质量,下列指标不在空气质量报告范围内的是________ (填字母)。
SO2浓度 b. CO2浓度 c. 可吸入颗粒物
②废旧电池处理不当易造成重金属污染,治理废水中的重金属污染物可用沉淀法。例如,往含铅(Pb2+)废水中加入Na2S使Pb2+转变为__________ (填化学式)沉淀而除去。
③硝酸型酸雨的形成主要是由汽车排放的尾气所致,汽车尾气中的氮氧化物可以用氨气来处理。例如,氨气与二氧化氮在催化剂作用下反应生成的均是对空气无污染的物质,请写出此时氨气与二氧化氮反应的化学方程式: ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____区,其基态原子价电子排布式为________。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____,与CN-互为等电子体的粒子有_____、________(写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________.中心原子杂化方式为________;HOCH2CN中元素电负性由大到小的顺序_______,1 mol HOCH2CN分子中,含有σ键的数为_________。
(4)ZnS和HgS晶体在岩浆中先晶出的是________,其原因是___________。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构的说法中不正确的是
A. 属于酯类的有4种 B. 既含有羟基又含有醛基的有3种
C. 存在分子中含有六元环的同分异构体 D. 属于羧酸类的有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 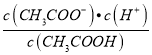
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
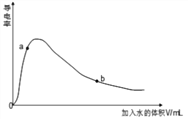
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com