
����Ŀ��������������������ͷ�չ����Ҫ���ʻ�����
��1���ֽ����������Ҫ�Ľ������ϣ��ֽ������______ (��ǡ����ǡ�)���ϲ��ϡ�
��2���л���������ʱ�����������ڼӹ����͡��л�������һ��_________���ϣ�ѡ������Ρ�����ά�������ϡ�����
��.��1���ҹ������������ٸ�ʻ��õ����ϡ����ϡ���ֱ���������Dz��о���������ɷ�Ϊ��ɫ�Ĺ���ͭ��(ͭΪ+2��)�����Ļ�ѧʽΪ��BaCuSi2Ox����x��ֵΪ _________
��2���ҹ������ġ���������������ʹ�����������˸��ϸ�ķ������ݡ�
�ٱ������żҿ����ѳɹ����2022�궬�»ᣬĿǰ��������������ȫ�����ƿ�������������ָ�겻�ڿ����������淶Χ�ڵ���________ (����ĸ)��
SO2Ũ�� b. CO2Ũ�� c. �����������
�ڷϾɵ�ش�������������ؽ�����Ⱦ��������ˮ�е��ؽ�����Ⱦ����ó����������磬����Ǧ(Pb2��)��ˮ�м���Na2SʹPb2��ת��Ϊ__________ (�ѧʽ)��������ȥ��
��������������γ���Ҫ���������ŷŵ�β�����£�����β���еĵ�����������ð��������������磬��������������ڴ��������·�Ӧ���ɵľ��ǶԿ�������Ⱦ�����ʣ���д����ʱ���������������Ӧ�Ļ�ѧ����ʽ�� ______________________��
���𰸡� �� ���� 6 b PbS 8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
��������������1���ֽ�������Ǹ��ϲ��ϣ����л������ǻ�����ϣ��ֽ���ǿ��������
��2���л�������һ�ֺϳ��л��߷��ӣ��������ϡ�
��.��1������ͭ��(ͭΪ+2��)�Ļ�ѧʽΪBaCuSi2Ox������ͭ���衢������Ԫ�صĻ��ϼ۷ֱ�Ϊ+2��+2��+4��-2���������ǵĻ��ϼ۴�����Ϊ0�����x��ֵΪ6.
��2�����ҹ�Ŀǰ�涨�����������������Ⱦ����Ҫ�ж������������������������������Ư�����ȣ�������̼���ڿ����������淶Χ�ڡ�
������Ǧ(Pb2��)��ˮ�м���Na2SʹPb2��ת��ΪPbS��������ȥ��
�۰�������������ڴ��������·�Ӧ���ɵľ��ǶԿ�������Ⱦ�����ʣ���ʱ���������������Ӧ�Ļ�ѧ����ʽΪ 8NH3+6NO2![]() 7N2+12H2O��
7N2+12H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��̬Feԭ����________��δ�ɶԵ��ӣ�Fe3���ĵ����Ų�ʽΪ ________���������軯�ؼ���Fe3�����γɵ���������ɫΪ________��
(2)���ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ��b�ļ۵��Ӳ��е�δ�ɶԵ�����3����c������������Ϊ���ڲ��������3���� d��cͬ�壻e�������ֻ��1�����ӣ����������18�����ӡ�b��c��d�е�һ������������________(��Ԫ�ط���)��e�ļ۲���ӹ��ʾ��ͼΪ________��
(3)X��Y��Z��RΪǰ������Ԫ�أ���ԭ��������������XY2�Ǻ���ɫ���壻X����Ԫ�ؿ��γ�XH3��Z��̬ԭ�ӵ�M����K���������ȣ�R2�����ӵ�3d�������9�����ӡ�
��ش��������⣺
Y��̬ԭ�ӵĵ����Ų�ʽ��_____��Z���������е�һ��������������Ԫ����______��
(4)��̬��ԭ�ӵĵ����Ų�ʽΪ______��Ga��̬ԭ�ӵĺ�������Ų�ʽ��______��Cu����̬��������Ų�ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�ҵ�ϣ�ͨ����п��ʯ��ȡӦ�ù㷺��п���仯���
��1��Zn��Ԫ�����ڱ���λ��_____�������̬ԭ�Ӽ۵����Ų�ʽΪ________��
��2��[Zn(CN)4]2-�����ڵ�ƹ�ҵ�У�������λԭ�ӻ�̬ʱ������ӵĹ����ʾʽΪ_____����CN-��Ϊ�ȵ������������_____��________��д�����֣���
��3��[Zn(CN)4]2-��ˮ��Һ�����ȩ��HCHO����Һ��Ӧ���Ƶ�HOCH2CN����ȩ���ӵ����幹��Ϊ________������ԭ���ӻ���ʽΪ________��HOCH2CN��Ԫ�ص縺���ɴ�С��˳��_______��1 mol HOCH2CN�����У�������������Ϊ_________��
��4��ZnS��HgS�������ҽ����Ⱦ�������________����ԭ����___________��
��5��ZnO��һ�־���ṹ����ʯ���ƣ�4 ��пԭ��ռ�ݽ��ʯ�о������ĸ�̼ԭ�ӵ�λ�ã������������ܶ�Ϊ______g/cm3���辧������Ϊapm��NA��ʾ����٤��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�л�������Ľṹ��ʽ��ͼ3�������ʾ���һ���ij��ݹ�Ч���йظû������˵����ȷ���ǣ� ��

A. ������FeCl3������ɫ��Ӧ��Ҳ�ܺ�NaHCO3��Ӧ�ų�CO2
B. 1 mol�û������������6 mol NaOH ��Ӧ
C. 1 mol �û�����������뺬5 mol Br2��Ũ��ˮ��Ӧ
D. �û���������к������ֺ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���Ũ��Ϊ0��1molL��1��Na2CO3��Һ100 mLʱ�����в�����ȷ����
A. ��������ƽ��ȡ1��06 g ��ˮ̼���ƣ����ձ��м�����ˮ�ܽ⣬����ȴ�����º���Һת�Ƶ�����ƿ��
B. ��ʹ������ƿǰ����������ƿ�Ƿ�����Լ�ƿ�����Ƿ�©ˮ
C. ����ʱ������ˮ�����̶��ߣ����ý�ͷ�ι�С���������ಿ��
D. ����ʱ�������ӣ���������Һ��Ũ�Ƚ�ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���̼��(H2CO3)����(H2SiO3)��˵���в���ȷ����( )
A. ���߾�Ϊ����
B. ���߾���ʹ��ɫʯ����Һ���ɫ
C. CO2����ͨ��Na2SiO3��Һ�п����Ƶù���
D. ��������ʱ�����Էֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֹ⻯ѧ��صĽṹ����ͼ���������ڱ���Ϳ���Ȼ�������Ƭ��ʱ��������Ӧ��AgCl(s) ![]() Ag(s)+Cl(AgCl)�� [Cl(AgCl)��ʾ���ɵ���ԭ���������Ȼ�������]������Cl(AgCl)+e����Cl��(aq)��������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ����
Ag(s)+Cl(AgCl)�� [Cl(AgCl)��ʾ���ɵ���ԭ���������Ȼ�������]������Cl(AgCl)+e����Cl��(aq)��������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ����

A. ����ʱ��������Y����X
B. ����ʱ����ת��0.1mole-ʱ��Pt�缫����0.05molCl2����
C. ����ʱ��Cl����Ag�缫�ƶ�
D. ����ʱ������ܷ�ӦΪ��AgCl(s) +Cu+(aq) ![]() Ag(s)+Cu2+(aq)+Cl��
Ag(s)+Cu2+(aq)+Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C1��ѧ�ֳ�һ̼��ѧ,�о��Ժ���һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ���л���ѧ�����գ������ڲ��Ͽ�ѧ�Ϳ������ȼ�Ϸ������Ҫ�����ѷ�չ��Ϊһ��ѧ�ơ�ȼú�����е�CO��CO2����ת��Ϊ��������ԭ�ϡ������Դ�״���
��3H2(g)+CO2(g)![]() CH3OH(g) + H2O(l) ��H1
CH3OH(g) + H2O(l) ��H1
��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
������֪��18gˮ�������Һ̬ˮ�ų�44KJ��������
��ѧ�� | C-H | C-O | C=O | H-H | O-H |
����/KJ/mol | 412 | 351 | 745 | 436 | 462 |
����H1_____________________
����һ�������£��ں��ݵ��ܱ�������Ͷ��1molCO ��2mol H2����Ӧ���ڴ��������³�ַ�Ӧ��CH3OH��ƽ�������е���������ڲ�ͬѹǿ�����¶ȵı仯��ͼl��ʾ��
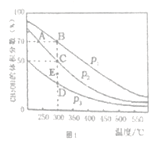
��1��ͼ��ѹǿ����Դ�С��P1______P2������>����<������=�������жϵ�������________
��2��A��B��C����Ļ�ѧƽ�ⳣ������Դ�СK(A)______K(B)_____ K(C)������>����<������=��) ������C���ѹǿƽ�ⳣ��Kp=__________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����������
��3��300����P2�����£�����E��ʱV��________V��������>����<������=����
��4��ij�¶��£�����˵���÷�Ӧ�����ﵽƽ��״̬����______________��
a�������ڵ��ܶȲ��ٱ仯
b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l
c����������������������ٱ仯
d. �����ڻ�������ƽ����Է����������ٱ仯
e�������ڸ���ֵ������������ٱ仯
��5����Ӧ��ʼ����C���ƽ�⣬�����ʵ�Ũ����ʱ��仯������ͼ2��ʾ�������¶Ȳ��䣬t1ʱ�ı�����Ϊ_________����ʱƽ��_______�������������ƶ����������ƶ��������ƶ��� )
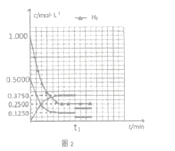
��.��ҵ�Ͽ�ͨ����ȩ�ʻ�������ȡ���������25��ʱ���䷴Ӧ���Ȼ�ѧ����ʽΪ��CH3OH(g)+CO(g) ![]() HCOOCH3(g)�������о�����ͼ��ʾ��
HCOOCH3(g)�������о�����ͼ��ʾ��
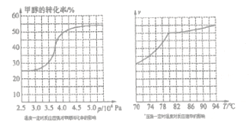
�����ݷ�Ӧ��ϵ��ѹǿ�Լ״�ת���ʵ�Ӱ�첢�ۺϿ��������ɱ����ص���_____�������������ĸ��
a. 3.5��106Pa b. 4.0��106Pac. 5.0��106Pa
��������������ȡ���������ʵ�ʹ�ҵ�����У����õ��¶���80������������_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������;�㷺����ش�
I.�����������£������е�NH4+���ձ�O2����ΪNO3-���÷�Ӧ�����ӷ���ʽΪ________��
��.��������Ҫ�Ļ���ԭ�ϡ���֪��25��ʱ��NH3��H2O�ĵ��볣��kb=1.79��10-5�����¶��£�1.79mol/LNH4Cl��Һ��pHԼΪ_____________��
��.��������ʻ�����������·�Ӧ������
��.N2(g)+O2(g)![]() 2NO(g) ��H=+180.7kJ/mol
2NO(g) ��H=+180.7kJ/mol
��.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5kJ/mol
N2(g)+2CO2(g) ��H=-746.5kJ/mol
��1���ܱ�ʾCOȼ���ȵ��Ȼ�ѧ����ʽΪ__________________��
��2����Ӧ����________����ϸߡ��ϵ͡����¶������Է����С�
��3��T�¶�ʱ����10L�����ܱ������г���2molNO��2molCO������Ӧii��5minʱ�ﵽƽ�⣬���0��5min�ڸ÷�Ӧ����v(N2)=0.016mol��L-1��min-1��
��T�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=____________________��
��ƽ��ʱ������ѹǿ����ʼʱ������ѹǿ֮��Ϊ_________________��
��4��һ�������£�����ʼ�ݻ�Ϊ5L�ĺ�ѹ�ܱ���������1molN2��1molO2������Ӧi��O2��ƽ��ת����(��)���¶�(T)�Ĺ�ϵ��ͼ1��ʾ������Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��
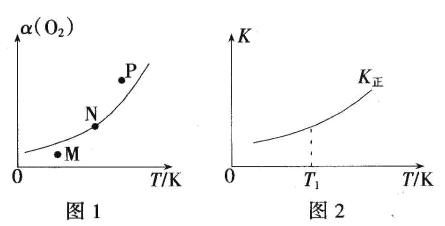
��ͼ1�У�M��N��P��������Ӧ��״̬�£�v(��)>v(��)����_______(����ĸ)������Ϊ______��
��T1�¶�ʱ��K��=1����O2��ƽ��ת����Ϊ________(������λ��Ч����)����ͼ2�л����淴Ӧƽ�ⳣ����K�������¶�(T)�Ĺ�ϵ���ߡ�________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com