
����Ŀ��C1��ѧ�ֳ�һ̼��ѧ,�о��Ժ���һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ���л���ѧ�����գ������ڲ��Ͽ�ѧ�Ϳ������ȼ�Ϸ������Ҫ�����ѷ�չ��Ϊһ��ѧ�ơ�ȼú�����е�CO��CO2����ת��Ϊ��������ԭ�ϡ������Դ�״���
��3H2(g)+CO2(g)![]() CH3OH(g) + H2O(l) ��H1
CH3OH(g) + H2O(l) ��H1
��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
������֪��18gˮ�������Һ̬ˮ�ų�44KJ��������
��ѧ�� | C-H | C-O | C=O | H-H | O-H |
����/KJ/mol | 412 | 351 | 745 | 436 | 462 |
����H1_____________________
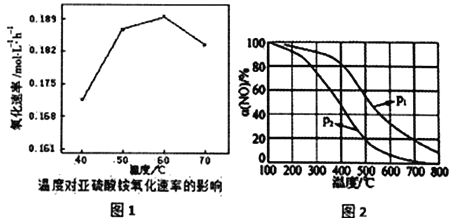
����һ�������£��ں��ݵ��ܱ�������Ͷ��1molCO ��2mol H2����Ӧ���ڴ��������³�ַ�Ӧ��CH3OH��ƽ�������е���������ڲ�ͬѹǿ�����¶ȵı仯��ͼl��ʾ��
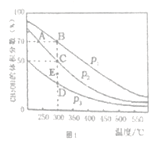
��1��ͼ��ѹǿ����Դ�С��P1______P2������>����<������=�������жϵ�������________
��2��A��B��C����Ļ�ѧƽ�ⳣ������Դ�СK(A)______K(B)_____ K(C)������>����<������=��) ������C���ѹǿƽ�ⳣ��Kp=__________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����������
��3��300����P2�����£�����E��ʱV��________V��������>����<������=����
��4��ij�¶��£�����˵���÷�Ӧ�����ﵽƽ��״̬����______________��
a�������ڵ��ܶȲ��ٱ仯
b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l
c����������������������ٱ仯
d. �����ڻ�������ƽ����Է����������ٱ仯
e�������ڸ���ֵ������������ٱ仯
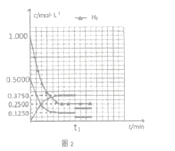
��5����Ӧ��ʼ����C���ƽ�⣬�����ʵ�Ũ����ʱ��仯������ͼ2��ʾ�������¶Ȳ��䣬t1ʱ�ı�����Ϊ_________����ʱƽ��_______�������������ƶ����������ƶ��������ƶ��� )
��.��ҵ�Ͽ�ͨ����ȩ�ʻ�������ȡ���������25��ʱ���䷴Ӧ���Ȼ�ѧ����ʽΪ��CH3OH(g)+CO(g) ![]() HCOOCH3(g)�������о�����ͼ��ʾ��
HCOOCH3(g)�������о�����ͼ��ʾ��
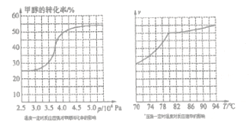
�����ݷ�Ӧ��ϵ��ѹǿ�Լ״�ת���ʵ�Ӱ�첢�ۺϿ��������ɱ����ص���_____�������������ĸ��
a. 3.5��106Pa b. 4.0��106Pac. 5.0��106Pa
��������������ȡ���������ʵ�ʹ�ҵ�����У����õ��¶���80������������_______
���𰸡� -219KJ/mol > ��ͼ���֪�����¶Ȳ���ʱ��P1�����´�ƽ��CH3OH������������Ӧ������Ϊ���������С�ķ�Ӧ��������������ʱ����ѹƽ�������ƶ���CH3OH������������� > = 27/P22 > ab ͨH2����H2Ũ�Ȳ��䣬�����������Ϊԭ�������� ƽ�ⲻ�ƶ� b ����80����Ӧ���ʽ�С������80���¶ȶԷ�Ӧ����Ӱ���С������ӦΪ���ȷ�Ӧ�������¶�ƽ������ת�ƣ�ת���ʽ���
����������Ӧ�ȣ���Ӧ�����֮�ͣ����������֮�ͣ�����Ϊ18gˮ�������Һ̬ˮ�ų�44kJ�����������H1����3��436+2��745��3��412��351��462��2��462-44��kJ/mol����219kJ/mol��
��1����ͼ���֪�����¶Ȳ���ʱ��P1�����´�ƽ��CH3OH������������Ӧ������Ϊ���������С�ķ�Ӧ��������������ʱ����ѹƽ�������ƶ���CH3OH�����������������P1��P2����2������ͼ���֪�����¶ȼ״��������ͣ���������Ӧ�Ƿ��ȷ�Ӧ��A���¶ȵ���B�㣬B��C���¶���ͬ���������ӦA��B��C����Ļ�ѧƽ�ⳣ������Դ�СK(A)��K(B)��K(C)��C��״�����Ϊ0.5��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ����mol�� 1 2 0
ת������mol�� x 2x x
ƽ������mol�� 1-x 2-2x x
��![]() �����x��0.75������C���ѹǿƽ�ⳣ��Kp=
�����x��0.75������C���ѹǿƽ�ⳣ��Kp=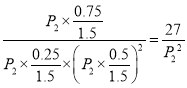 ����3��300�棬P2�����£�E��Ҫ�ﵽƽ��״̬�״��ĺ������ߣ�ƽ��������Ӧ������У�����E��ʱV����V������4��a���ܶ��ǻ��������������ݻ��ı�ֵ���ڷ�Ӧ�����ж��߾����䣬���������ڵ��ܶȲ��ٱ仯����˵����Ӧ�ﵽƽ��״̬��a����b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l����˵�����淴Ӧ������ȣ���һ������ƽ��״̬��b����c����������������������ٱ仯˵����Ӧ�ﵽƽ��״̬��c��ȷ��d. �������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����������ڻ�������ƽ����Է����������ٱ仯˵����Ӧ�ﵽƽ��״̬��d��ȷ��e�������ڸ���ֵ������������ٱ仯˵����Ӧ�ﵽƽ��״̬��e��ȷ����ѡab����5������ͼ���֪����Ũ�Ȳ��䣬���������ʵ�Ũ�ȱ�Ϊԭ����1/2�����Ա����¶Ȳ��䣬t1ʱ�ı�����ΪͨH2����H2Ũ�Ȳ��䣬�����������Ϊԭ������������ʱŨ������Ȼ����ƽ�ⳣ�������ƽ�ⲻ�ƶ���
����3��300�棬P2�����£�E��Ҫ�ﵽƽ��״̬�״��ĺ������ߣ�ƽ��������Ӧ������У�����E��ʱV����V������4��a���ܶ��ǻ��������������ݻ��ı�ֵ���ڷ�Ӧ�����ж��߾����䣬���������ڵ��ܶȲ��ٱ仯����˵����Ӧ�ﵽƽ��״̬��a����b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l����˵�����淴Ӧ������ȣ���һ������ƽ��״̬��b����c����������������������ٱ仯˵����Ӧ�ﵽƽ��״̬��c��ȷ��d. �������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����������ڻ�������ƽ����Է����������ٱ仯˵����Ӧ�ﵽƽ��״̬��d��ȷ��e�������ڸ���ֵ������������ٱ仯˵����Ӧ�ﵽƽ��״̬��e��ȷ����ѡab����5������ͼ���֪����Ũ�Ȳ��䣬���������ʵ�Ũ�ȱ�Ϊԭ����1/2�����Ա����¶Ȳ��䣬t1ʱ�ı�����ΪͨH2����H2Ũ�Ȳ��䣬�����������Ϊԭ������������ʱŨ������Ȼ����ƽ�ⳣ�������ƽ�ⲻ�ƶ���
��.�ٸ���ͼ���֪ 4.0��106Paʱ�״���ת�����Ѿ��ܸߣ�������ѹǿת���ʱ仯���������������ɱ������Դ�ѡb���ڵ���80����Ӧ���ʽ�С������80���¶ȶԷ�Ӧ����Ӱ���С������ӦΪ���ȷ�Ӧ�������¶�ƽ������ת�ƣ�ת���ʽ��ͣ������ȡ���������ʵ�ʹ�ҵ�����У����õ��¶���80�档


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӏ�������ֵ������˵���в���ȷ����
A. 0.1mol-NH2(����)�������еĵ�����Ϊ0.9NA
B. lmol D218O������������Ϊ12NA
C. 14 g����ϩ��۱�ϩ�Ļ�����к�Hԭ�ӵ���ĿΪ2NA
D. ���������£�0.2 mol SO2������O2��ַ�Ӧ�����ɵ�SO3������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ͷ�չ����Ҫ���ʻ�����
��1���ֽ����������Ҫ�Ľ������ϣ��ֽ������______ (��ǡ����ǡ�)���ϲ��ϡ�
��2���л���������ʱ�����������ڼӹ����͡��л�������һ��_________���ϣ�ѡ������Ρ�����ά�������ϡ�����
��.��1���ҹ������������ٸ�ʻ��õ����ϡ����ϡ���ֱ���������Dz��о���������ɷ�Ϊ��ɫ�Ĺ���ͭ��(ͭΪ+2��)�����Ļ�ѧʽΪ��BaCuSi2Ox����x��ֵΪ _________
��2���ҹ������ġ���������������ʹ�����������˸��ϸ�ķ������ݡ�
�ٱ������żҿ����ѳɹ����2022�궬�»ᣬĿǰ��������������ȫ�����ƿ�������������ָ�겻�ڿ����������淶Χ�ڵ���________ (����ĸ)��
SO2Ũ�� b. CO2Ũ�� c. �����������
�ڷϾɵ�ش�������������ؽ�����Ⱦ��������ˮ�е��ؽ�����Ⱦ����ó����������磬����Ǧ(Pb2��)��ˮ�м���Na2SʹPb2��ת��Ϊ__________ (�ѧʽ)��������ȥ��
��������������γ���Ҫ���������ŷŵ�β�����£�����β���еĵ�����������ð��������������磬��������������ڴ��������·�Ӧ���ɵľ��ǶԿ�������Ⱦ�����ʣ���д����ʱ���������������Ӧ�Ļ�ѧ����ʽ�� ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ���ʽΪC4H8O2���л����ͬ���칹��˵���в���ȷ����
A. �����������4�� B. �Ⱥ����ǻ��ֺ���ȩ������3��
C. ���ڷ����к�����Ԫ����ͬ���칹�� D. �������������2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�����ֶ���������Ԫ�أ����ǵ�ԭ������������������A��D��C��F�ֱ���ͬһ����Ԫ�أ�AԪ�ص�һ�ֺ��������ӣ�FԪ�ص������������Ǵ�����������0.75����BԪ�صĵ��������������ڲ��������2����EԪ�ص�������������������Ӳ�������ش�
��1��A��D��F�γɻ�����ĵ���ʽ_____________��
��2����ҵ���ڸ��µ������£�������A2C��BC��Ӧ��ȡ����A2����2L�ܱ������зֱ����1 mol A2C��1 mol BC�� ���������£�2 min��ƽ��ʱ����0.4mol A2������BC��ʾ�ķ�Ӧ����Ϊ________�����й��ڸ÷�Ӧ��˵������ȷ����__________________��
A.����BC2��Ũ��ʼ�ղ����������Ӧ����
B.�����������ܶȲ��ٷ����仯����Ӧ�ﵽ�����
C.A2��һ�ָ�Ч��������Դ
D.������1 molA2��ת��2mol����
��3����AԪ�صĵ�����CԪ�صĵ��ʼ���A��C��D����Ԫ����ɵĻ��������Һ����ȼ�ϵ�أ�д���õ�صĵ缫��Ӧʽ������____________������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ����ˮ������ʵ�飬��Ҫ�õ��������ǣ� ��
A. �¶ȼ�B. ������C. ������D. �ƾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3�������������ᡢ����ȣ�����������������������
��1��������ˮ���������еĶ�����������ط�Ӧ����Ҫ�Ȼ�ѧ����ʽ���£�
SO2(g)+NH3H2O(aq)�TNH4HSO3(aq) ��H1=akJmol-1
NH3H2O(aq)+NH4HSO3(aq)�T(NH4)2SO3(aq)+H2O(l) ��H2=bkJmol-1
2(NH4)2SO3(aq)+O2(g)�T2(NH4)2SO4(aq) ��H3=ckJmol-1
�ٷ�Ӧ2SO2(g)+4NH3H2O(aq)+O2(g)�T2(NH4)2SO4(aq)+2H2O(l)�ġ�H=____kJmol-1��
�ڿ�������(NH4)2SO3���������¶ȵı仯��ͼ��ʾ�����������(NH4)2SO3�������¶�Ϊ________��
�ۺϳɰ��õ��������Լ���Ϊԭ���Ƶã�CH4(g)+H2O(g)CO(g)+3H2(g)�������е�CO�Ժϳɰ��Ĵ����ж������ã��������������ͭ������Һ������ԭ������CO���䷴Ӧԭ��Ϊ��
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)![]() [Cu(NH3)3]CH3COOCO(l) ��H��0��
[Cu(NH3)3]CH3COOCO(l) ��H��0��
����CO������������ͭ��I����Һ�����ʵ��������ֿ��������ָ�������CO�������Թ�ѭ��ʹ�ã�����������������___________________��������ĸ��
A�����¡���ѹB�����¡���ѹC�����¡���ѹD�����¡���ѹ
��2��NH3���������Ʊ����ᡣ4NH3(g)+5O2(g)�T4NO(g)+6H2O(g)���ɵ�NO��O2����ΪNO2��������������ʱ��NO��������[��(NO)]���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����p1____p2�����������������=�������¶ȸ���800��ʱ����(NO)����Ϊ0��ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������������.������д,�����ɶ϶�����ʽΪC5H10O��ȩӦ��
A. 3��B. 4��C. 5��D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A��B��C��D��E��F��Ϊ���ڱ���ǰ������Ԫ�أ���ԭ������������������A��B��CΪ�����ڷǽ���Ԫ�ء�A���γɻ�������������Ԫ�أ�Bԭ�ӻ�̬�����Ų���ֻ��һ��δ�ɶԵ��ӣ�C��ͬ����Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ�D�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е��� ������ࣻE��D���ڣ�E��ij��������X��C���⻯���Ũ��Һ����ʱ��Ӧ������ʵ������ȡ��̬����C��F��D��������������ȡ��ش��������⣨��ػش����Ԫ�ط��ű�ʾ����
(1)DԪ����Ԫ�����ڱ���λ����__________________��
(2)A2H2������Aԭ�ӹ�����ӻ�����Ϊ_______��lmol A2H2���Цļ�����ĿΪ_____��B2ͨ��ϡNaOH��Һ�п�����OB2��OB2���ӹ���Ϊ_____________��
(3)��F���ʵķ�ĩ����NH3��Ũ��Һ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ���÷�Ӧ����
�ӷ���ʽ��______________________��
(4)X����ȡC�����е�������______________��C��ij�ֺ������γ�����ʵ��������ȡ����������������л�ѧ���ļ���_______(�>����=�� ��<��)109��28��
(5)��֪F��C��ij�ֻ�����ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ��_________����F��Cԭ������ľ���Ϊacm����þ�����ܶ�Ϊ_______g �M-3(ֻҪ������ʽ�����ؼ�������֣�����٤����������ֵΪNA)��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com