
����Ŀ��
A��B��C��D��E��F��Ϊ���ڱ���ǰ������Ԫ�أ���ԭ������������������A��B��CΪ�����ڷǽ���Ԫ�ء�A���γɻ�������������Ԫ�أ�Bԭ�ӻ�̬�����Ų���ֻ��һ��δ�ɶԵ��ӣ�C��ͬ����Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ�D�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е��� ������ࣻE��D���ڣ�E��ij��������X��C���⻯���Ũ��Һ����ʱ��Ӧ������ʵ������ȡ��̬����C��F��D��������������ȡ��ش��������⣨��ػش����Ԫ�ط��ű�ʾ����
(1)DԪ����Ԫ�����ڱ���λ����__________________��
(2)A2H2������Aԭ�ӹ�����ӻ�����Ϊ_______��lmol A2H2���Цļ�����ĿΪ_____��B2ͨ��ϡNaOH��Һ�п�����OB2��OB2���ӹ���Ϊ_____________��
(3)��F���ʵķ�ĩ����NH3��Ũ��Һ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ���÷�Ӧ����
�ӷ���ʽ��______________________��
(4)X����ȡC�����е�������______________��C��ij�ֺ������γ�����ʵ��������ȡ����������������л�ѧ���ļ���_______(�>����=�� ��<��)109��28��
(5)��֪F��C��ij�ֻ�����ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ��_________����F��Cԭ������ľ���Ϊacm����þ�����ܶ�Ϊ_______g �M-3(ֻҪ������ʽ�����ؼ�������֣�����٤����������ֵΪNA)��

���𰸡� �������ڡ�VIB�� SP�ӻ� 3NA V�� 2Cu+8NH3��H2O+O22[Cu(NH3)4]2++4OH-+6H2O ������ < CuCl ![]()
��������A��B��C��D��E��F��Ϊ���ڱ���ǰ������Ԫ�أ���ԭ������������������A��B��CΪ�����ڷǽ���Ԫ�أ�A���γɻ�������������Ԫ�أ���AΪ̼Ԫ�أ�Bԭ�ӻ�̬�����Ų���ֻ��һ��δ�ɶԵ��ӣ���Χ�����Ų�Ϊns2np1��ns2np5�����ԭ��������BΪ�ǽ�����Ԫ�أ�����֪��Χ�����Ų�Ϊns2np5��C��ͬ����Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ����ڢ�A�壬����֪BΪFԪ�ء�CΪClԪ�أ�D�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������࣬��ԭ����Χ�����Ų�ʽΪ1s22s22p63s23p63d54s1����DΪCr��E��D���ڣ�E��ij��������X��HCl��Ũ��Һ����ʱ��Ӧ������ʵ������ȡ��̬����Cl2����EΪMn��XΪMnO2��F��D��������������ȣ����������Ų�Ϊns1��ԭ����������Cr����FΪCu��
��1��D�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������࣬���������Ų�ʽ��1s22s22p63s23p63d54s1�������ڱ���λ�ã��������ڡ�VIB�壻
��2�� A2H2����ΪC2H2����Ȳ��C�γ�2���Ҽ���2���м���ԭ�ӹ�����ӻ�����ΪSP�ӻ���lmol A2H2���Цļ�����ĿΪ3mol��B2ͨ��ϡNaOH��Һ�п�����OB2��OF2����ԭ�����γ�2���Ҽ���2���µ��Ӷԣ�ΪSP3�ӻ���OF2���ӹ���ΪV�Ρ�
(3)��F���ʵķ�ĩCu����NH3��Ũ��Һ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ���÷�Ӧ�����ӷ���ʽ��2Cu+8NH3��H2O+O22[Cu(NH3)4]2++4OH-+6H2O ��
(4)MnO2��HCl��Ũ��Һ����ʱ��Ӧ������ʵ������ȡ��̬����Cl2��X����ȡC�����е���������������C��ij�ֺ������γ�����ʵ��������ȡ���������������ΪClO3����Clԭ�Ӽ۲���Ӷ���=![]() ������1�Թ¶Ե��ӣ�Ϊ�����Σ��ʻ�ѧ���ļ��ǣ�109��28��
������1�Թ¶Ե��ӣ�Ϊ�����Σ��ʻ�ѧ���ļ��ǣ�109��28��
��5���ɾ����ṹ��֪�������к�ɫ����Ŀ=4����ɫ����Ŀ=8��1/8+6��1/2=4���ʸû�����Ļ�ѧʽ��CuCl������������=4��99.5/NAg�������к�ɫ������Χ��4����ɫ���γ���������ṹ����Cu��Clԭ������ľ���Ϊa cm����ͼ�������壺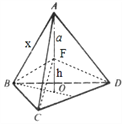 ������F��A��B��C��D��������A-BCD����Ϊ��4�����������������V����A-BCD=4V����F-BCD����
������F��A��B��C��D��������A-BCD����Ϊ��4�����������������V����A-BCD=4V����F-BCD����![]() ����h=a/3,������������ⳤΪx cm������AF���ӳ���������BCD��O��OΪ��������BCD�����ģ�BO��ֱƽ��CD����BO�ij���=
����h=a/3,������������ⳤΪx cm������AF���ӳ���������BCD��O��OΪ��������BCD�����ģ�BO��ֱƽ��CD����BO�ij���= ![]() ,��ֱ��������BOF�У�
,��ֱ��������BOF�У� ![]() , ���x=
, ���x=![]() ���ʾ������ⳤ=
���ʾ������ⳤ= ![]() ���þ�����ܶ�Ϊ
���þ�����ܶ�Ϊ![]() g �M-3
g �M-3


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C1��ѧ�ֳ�һ̼��ѧ,�о��Ժ���һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ���л���ѧ�����գ������ڲ��Ͽ�ѧ�Ϳ������ȼ�Ϸ������Ҫ�����ѷ�չ��Ϊһ��ѧ�ơ�ȼú�����е�CO��CO2����ת��Ϊ��������ԭ�ϡ������Դ�״���
��3H2(g)+CO2(g)![]() CH3OH(g) + H2O(l) ��H1
CH3OH(g) + H2O(l) ��H1
��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
������֪��18gˮ�������Һ̬ˮ�ų�44KJ��������
��ѧ�� | C-H | C-O | C=O | H-H | O-H |
����/KJ/mol | 412 | 351 | 745 | 436 | 462 |
����H1_____________________
����һ�������£��ں��ݵ��ܱ�������Ͷ��1molCO ��2mol H2����Ӧ���ڴ��������³�ַ�Ӧ��CH3OH��ƽ�������е���������ڲ�ͬѹǿ�����¶ȵı仯��ͼl��ʾ��
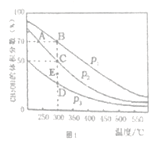
��1��ͼ��ѹǿ����Դ�С��P1______P2������>����<������=�������жϵ�������________
��2��A��B��C����Ļ�ѧƽ�ⳣ������Դ�СK(A)______K(B)_____ K(C)������>����<������=��) ������C���ѹǿƽ�ⳣ��Kp=__________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����������
��3��300����P2�����£�����E��ʱV��________V��������>����<������=����
��4��ij�¶��£�����˵���÷�Ӧ�����ﵽƽ��״̬����______________��
a�������ڵ��ܶȲ��ٱ仯
b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l
c����������������������ٱ仯
d. �����ڻ�������ƽ����Է����������ٱ仯
e�������ڸ���ֵ������������ٱ仯
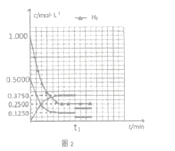
��5����Ӧ��ʼ����C���ƽ�⣬�����ʵ�Ũ����ʱ��仯������ͼ2��ʾ�������¶Ȳ��䣬t1ʱ�ı�����Ϊ_________����ʱƽ��_______�������������ƶ����������ƶ��������ƶ��� )
��.��ҵ�Ͽ�ͨ����ȩ�ʻ�������ȡ���������25��ʱ���䷴Ӧ���Ȼ�ѧ����ʽΪ��CH3OH(g)+CO(g) ![]() HCOOCH3(g)�������о�����ͼ��ʾ��
HCOOCH3(g)�������о�����ͼ��ʾ��
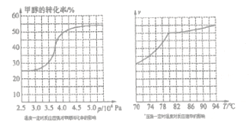
�����ݷ�Ӧ��ϵ��ѹǿ�Լ״�ת���ʵ�Ӱ�첢�ۺϿ��������ɱ����ص���_____�������������ĸ��
a. 3.5��106Pa b. 4.0��106Pac. 5.0��106Pa
��������������ȡ���������ʵ�ʹ�ҵ�����У����õ��¶���80������������_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������;�㷺����ش�
I.�����������£������е�NH4+���ձ�O2����ΪNO3-���÷�Ӧ�����ӷ���ʽΪ________��
��.��������Ҫ�Ļ���ԭ�ϡ���֪��25��ʱ��NH3��H2O�ĵ��볣��kb=1.79��10-5�����¶��£�1.79mol/LNH4Cl��Һ��pHԼΪ_____________��
��.��������ʻ�����������·�Ӧ������
��.N2(g)+O2(g)![]() 2NO(g) ��H=+180.7kJ/mol
2NO(g) ��H=+180.7kJ/mol
��.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5kJ/mol
N2(g)+2CO2(g) ��H=-746.5kJ/mol
��1���ܱ�ʾCOȼ���ȵ��Ȼ�ѧ����ʽΪ__________________��
��2����Ӧ����________����ϸߡ��ϵ͡����¶������Է����С�
��3��T�¶�ʱ����10L�����ܱ������г���2molNO��2molCO������Ӧii��5minʱ�ﵽƽ�⣬���0��5min�ڸ÷�Ӧ����v(N2)=0.016mol��L-1��min-1��
��T�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=____________________��
��ƽ��ʱ������ѹǿ����ʼʱ������ѹǿ֮��Ϊ_________________��
��4��һ�������£�����ʼ�ݻ�Ϊ5L�ĺ�ѹ�ܱ���������1molN2��1molO2������Ӧi��O2��ƽ��ת����(��)���¶�(T)�Ĺ�ϵ��ͼ1��ʾ������Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��
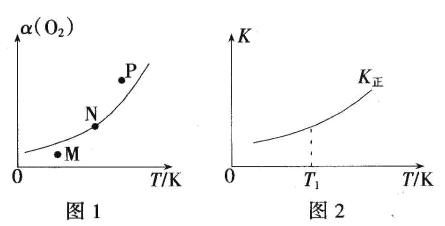
��ͼ1�У�M��N��P��������Ӧ��״̬�£�v(��)>v(��)����_______(����ĸ)������Ϊ______��
��T1�¶�ʱ��K��=1����O2��ƽ��ת����Ϊ________(������λ��Ч����)����ͼ2�л����淴Ӧƽ�ⳣ����K�������¶�(T)�Ĺ�ϵ���ߡ�________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1���������ŵIJ�ͬ�����Զ��л�����з��࣬��ָ�������л�������࣬���ں����ϡ�
�� ![]() __________�� ��
__________�� �� ![]() ___________��
___________��
��![]() ____________ ����
____________ ����![]() ��
��
��![]() ___________��
___________��
��2��ij��A 0.2 mol�������г��ȼ�պ����ɻ�����B��C��1 mol��
����A�ķ���ʽΪ ��
������A����ʹ��ˮ��ɫ������һ�������£�����Cl2����ȡ����Ӧ����һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ ��
������A��ʹ��ˮ��ɫ���ڴ�����������H2�ӳɣ���ӳɲ�������к���3��������A���ܵĽṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£���������������ڷֱ������![]() N��l3C��18O����ԭ�ӹ��ɵ�һ��������һ����̼������˵����ȷ����
N��l3C��18O����ԭ�ӹ��ɵ�һ��������һ����̼������˵����ȷ����
A. ����������������������ͬ B. ������ͬ�ķ������͵�����
C. ������ͬ���������������� D. ������ͬ��Ŀ�����ӡ�ԭ�Ӻͷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ��������˵����ȷ���ǣ� ��

A. ��AΪAlCl3��Һ��B����Ϊ��ˮ����Ӧ�ٵ����ӷ���ʽΪ��A13++4NH3��H2O=AlO2+ 4NH4++2H2O
B. ��AΪFe��B����Ϊϡ���ᣬ��Ӧ�ڵ����ӷ���ʽΪ: 3Fe+8H++2NO3=3Fe2++2NO��+4H2O
C. ��AΪNaOH��Һ��B����ΪCO2������Ca(OH)2��Һ����C��D��Һ
D. ��AΪCl2��B����ΪNH3��ʵ���ҿ��ü��ȹ���C�ķ�����ȡNH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ԡ���ԭ�Ե�ǿ�������������ʵĽṹ�йأ��������ʵ�Ũ�Ⱥͷ�Ӧ�¶��йء����и������ʷ�Ӧ���������ʵ�Ũ���йص���(����)
��ͭ��������Һ����ͭ���Ȼ�����Һ����п��������Һ ������������Һ
A. �٢� B. �ۢ� C. �٢� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڴ�����������Һ�巴Ӧ������������ˮ��Ӧ���ü���Ҳ���������ԭ���ǣ� ��
A. �������ǻ��Ӱ�죬ʹ��������ԭ�ӻ���
B. �������ǻ��Ӱ�죬ʹ�ǻ�����ԭ�ӱ����
C. �ǻ�Ӱ���˱�����ʹ�����ϵ���ԭ�ӱ����
D. ����Ӱ���ǻ���ʹ�ǻ��ϵ���ԭ�ӱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ����Ľṹ��ʽΪ:![]() ,������ˮ������˵����ȷ����(����)
,������ˮ������˵����ȷ����(����)
A. 1 molƻ�������3 mol NaOH�����кͷ�Ӧ
B. ƻ�����һ�����۲�����![]()
C. ��1 molƻ�����ϡ��Һ����������Na��Ӧ����1.5 mol H2
D. ƻ����Ĵ����������ܷ���������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com