
【题目】
(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
① ![]() __________; ②
__________; ② ![]() ___________;
___________;
③![]() ____________ ;④
____________ ;④![]() ;
;
⑤![]() ___________;
___________;
(2)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1 mol。
①烃A的分子式为 。
②若烃A不能使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 。
③若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为 ;
【答案】(1)酯; 酚;醛;卤代烃; 羧酸;
(2)、①C5H10 ②![]() ③
③ ![]() 、
、![]() 、
、![]()
【解析】
试题分析:(1)① ![]() 含有酯基,属于酯类;②
含有酯基,属于酯类;② ![]() 含有酚羟基,属于酚类③
含有酚羟基,属于酚类③![]() 含有醛基属于醛; ④
含有醛基属于醛; ④![]() 含有卤素原子,属于卤代烃;⑤
含有卤素原子,属于卤代烃;⑤![]() 含有羧基属于羧酸。
含有羧基属于羧酸。
(2)①烃含有C、H两种元素,某烃A 0.2mol在氧气的充分燃烧后生成化合物B,C各1mol,即生成CO2、H2O各1mol,根据原子守恒,烃A的分子式为C5H10; 烃A不能使溴水褪色,故不存在双键,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,说明高度对称,则A的结构简式为![]() ;烃A能使溴水褪色,据不饱和度,A中含有一个双键,属于戊烯,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为
;烃A能使溴水褪色,据不饱和度,A中含有一个双键,属于戊烯,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为![]() 、
、![]() 、
、![]()


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构的说法中不正确的是
A. 属于酯类的有4种 B. 既含有羟基又含有醛基的有3种
C. 存在分子中含有六元环的同分异构体 D. 属于羧酸类的有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 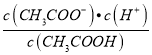
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
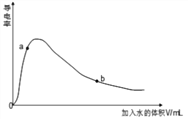
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有_______(填序号)。
A.矿石加入沸腾护之前先粉碎
B.使用V2O5作催化剂
C.接触室中不使用很高的温度
D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行
(2)若实验室在537℃、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入2mol SO2和2mol O2,此时体积为10L,在温度和压强不变条件下20分钟后反应达到平衡,SO3体积分数为0.5。
①该温度下,从反应开始至平衡时氧气的平均反应速率是_______;
②该温度下,反应2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数的值为_______________。
2SO3(g)的平衡常数的值为_______________。
(3)工业上冶炼铜主要以黄铜矿(主要成分CuFeS2)为原料,经过多歩反应将铜元素还原为铜。其中有一步为:2Cu2S+3O2(g) === 2Cu2O+2SO2。试从反应的自发性判断此反应的ΔH________0 (填“>”、“=”或“<”)。
(4)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如图,是电解产生多硫化物的实验装置:
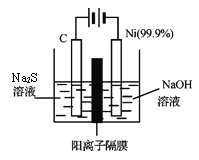
①已知阳极的反应为:(x+1)S2-=== Sx+S2-+2xe-,则阴极的电极反应式是:__________。当反应转移xmol电子时,产生的气体体积为_________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子方程式表示):____________。溶液中离子浓度由大到小的顺序____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R是原子序数依次增大的短周期主族元素,X在周期表中原子半径最小,Y与Z相邻,Z、R在地壳中的含量位列前两位,M为短周期中电负性最小的元素。请回答:
(1)基态Z原子的外围电子排布图为____________。
(2)X与Y能形成多种化合物,其中Y2X2分子中σ键、π键的数目之比为_______。
(3)在R3Y4晶体中键角:Y-R-Y____R-Y-R(填“>”“<”或“=”),原因为________。
(4)钨(W)元素可以和Z、M形成多种化合物,其中一种化合物的晶体结构如图:

已知:相邻Z原子的核间距为apm,钨原子位于Z原子形成的正八面体的体心,M离子位于钨原子形成的立方体的体心。
①与M原子距离最近且相等的Z原子的数目为_________。
②晶体的化学式为__________。
③设NA为阿伏加德罗常数的值,则晶体的密度为______g/cm3(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素。A是形成化合物种类最多的元素;B原子基态电子排布中只有一个未成对电子;C是同周期元素中原子半径最小的元素;D的基态原子在前四周期元素的基态原子中单电 子数最多;E与D相邻,E的某种氧化物X与C的氢化物的浓溶液加热时反应常用于实验室制取气态单质C;F与D的最外层电子数相等。回答下列问题(相关回答均用元素符号表示):
(1)D元素在元素周期表的位置是__________________。
(2)A2H2分子中A原子轨道的杂化类型为_______,lmol A2H2含有δ键的数目为_____,B2通入稀NaOH溶液中可生成OB2,OB2分子构型为_____________。
(3)将F单质的粉末加人NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离
子方程式是______________________。
(4)X在制取C单质中的作用是______________,C的某种含氧酸盐常用于实验室制制取氧气,此酸根离子中化学键的键角_______(填“>”“=” 或“<”)109°28。
(5)已知F与C的某种化合物的晶胞结构如图所示,则该化合物的化学式是_________,若F与C原子最近的距离为acm,则该晶体的密度为_______g ㎝-3(只要求列算式,不必计算出数字,阿伏伽徳罗常数的数值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C4H8O2,下列有关其同分异构体数目的说法中正确的是( )
A. 属于酯类的有4种
B. 属于羧酸的有3种
C. 既含有羟基又含有醛基的有3种
D. 不可能存在分子中含有六元环的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钢铁发生吸氧腐蚀的分析正确的是
A. 吸氧腐蚀是吸热反应 B. 铁作原电池正极
C. 正极电极反应为:2H2O+O2+4e-=4OH- D. 原电池负极反应为:Fe-3e-=Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com