
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得
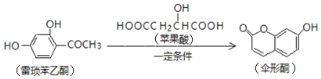
下列说法中正确的是( )
A.一分子反应物雷琐苯乙酮含有3个碳碳双键
B.苹果酸的一种缩聚产物是![]()
C.1mol产物伞形酮与足量NaOH溶液反应,最多可消耗2molNaOH
D.反应中涉及到的三种有机物都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向![]() 溶液中滴加少量氯水,再加入
溶液中滴加少量氯水,再加入![]() 溶液振荡,静置,有机层呈橙色
溶液振荡,静置,有机层呈橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数与s电子数相等 |
C基态原子的价电子排布为nsn-1npn+1 |
D的能层数与C相同,且电负性比C大 |
E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
F是前四周期中电负性最小的元素 |
G在周期表的第五列 |
(1)C基态原子中能量最高的电子,其电子云在空间有____个方向,原子轨道呈____形,C简单离子核外有___种运动状态不同的电子。
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是___;
②A2B2难溶于CS2,简要说明理由:________。
(3)G位于____族___区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为____;
(4)ED3分子的VSEPR模型名称为____,其中E原子的杂化轨道类型为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题
(1)写出氮元素的原子结构示意图:_____________。
(2)将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(3)写出实验室制取氨气的化学反应方程式_______________。
(4)如图是实验室制取氨气的装置,请指出图中错误之处:______________。

(5)用如图装置进行喷泉实验,挤压滴管的胶头时,现象_________。

(6)若实验室要收集一定量的氨气应用什么方法收集:____________。
(7)请写出氨气的催化氧化反应方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 一定温度下,可逆反应2X(g)+Y(g)![]() 2Z(g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
2Z(g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
C. 升高温度,AgCl的溶解度增大,Ksp增大
D. FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com