
【题目】某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )![]()
A.钠着火燃烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
D.根据管右端棉球颜色的变化可判断氯气是否被碱液完全吸收
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某温度下,Kw=10﹣12 . 若保持温度不变,向少量水中加入g的NaOH固体,并加水稀释至1L,才能使溶液中水电离产生的H+、OH﹣的浓度乘积即:c(H+)水c(OH﹣)水=10﹣26 . 若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH﹣)=1010 , 则此时水电离的c(OH﹣)=molL﹣1 .
(2)一定温度下,现有a.盐酸,b.硫酸,c.醋酸 三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是 . (用a、b、c表示)
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 . (用a、b、c表示)
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 . (用a、b、c表示)
(3)现有两瓶pH=2的盐酸和醋酸溶液,简述如何用最简单的方法区别盐酸和醋酸.(限选试剂:石蕊试液、酚酞试液、pH试纸、蒸馏水).采用的方法为 .
(4)执信中学A学生为了测定某烧碱样品的纯度,准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.用0.200 0molL﹣1的标准盐酸进行滴定,选择甲基橙作指示剂,试根据实验回答下列问题:
①滴定过程中,眼睛应注视;滴定终点时,溶液从色变为色, .
②观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果(填“偏高”、“偏低”或“无影响”);若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果(填“偏高”、“偏低”或“无影响”).
③根据如表数据,通过标准酸滴定,计算待测烧碱溶液的物质的量浓度是 , 烧碱样品的纯度是 . (本小题计算结果保留4位有效数字)
滴定次数 | 待测溶液 | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的 | ||
第①次 | 10.00 | 0.40 | 20.50 |
第②次 | 10.00 | 4.10 | 24.00 |
第③次 | 10.00 | 2.20 | 23.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池量急速增加所引起的铅污染日益严重.工业上从废铅蓄电池的铅膏中回收铅的工艺流程如图 
(1)铅蓄电池的总反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,该蓄电池放电时的负极反应式为 , 放电后该电极质量(填“增大”“减小”或“不变”).
(2)步骤①中加入Na2SO3的作用是 .
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法: .
(4)若用NH4HCO3和NH3H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理.图2是NH4HCO3和NH3H2O用量对含铅渣泥中脱硫率的影响:
从图形可以看出,应选择NH4HCO3和NH3H2O用量为理论用量的倍.该条件下步骤③从母液可获得副产品为 .
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼.则阳极的电极材料是 , 阴极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对地球上的生物相当重要,它是许多食物和肥料的重要成分.氨也是制造硝酸、化肥、炸药的重要原料.氨在国民经济中占有重要地位.回答下列问题:
(1)合成氨工业中,合成塔中每产生2mol NH3 , 放出92.2kJ热量.
①工业合成氨的热化学方程式是 .
②若起始时向容器内放入1mol N2和3mol H2 , 达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为;若在同体积的容器中充人2mol N2和6molH2 , 达平衡后放出的热量为Q2 kJ,则Q2(填“>”、“<”或“=”)2Q1 .
③已知:
1mol N﹣H键断裂吸收的能量约等于kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2(g)2NH3 (g),其平衡常数K与温度T的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
①平衡常数表达式K= , K1(填“>”、“<”或“一”)K2 .
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是(填字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应(填“处于”或“不处于”)平衡状态.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 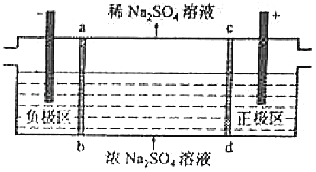
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.2g氢气所含原子数目为NA
B.标准状况下,11.2L H2O所含分子数为0.5NA
C.1molL﹣1 CaCl2溶液中所含Ca2+离子的数目为NA
D.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)NH2COONH4(s)
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
(1)该反应在一定条件下能够自发进行,则反应的△H0.(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式 .
(3)实验步骤如下:
步骤1:按图所示组装仪器,检查装置气密性.
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水.
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品…
①干燥管中盛放的药品是 .
②对比碳酸盐和酸反应制CO2 , 该实验利用干冰升华产生CO2气体的优点有 , .
③以恒压滴液漏斗代替分液漏斗的目的是 .
④反应后期CO2气流量下降时,可采取的相应措施是 .
(4)该实验装置可能面临的安全问题是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组的同学设计的4个喷泉实验方案.下列有关操作不可能引发喷泉现象的是( ) 
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com