
下列实验正确且能达到目的是
A.溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体
HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体
B.在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4
C.用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸
D.亚硫酸钠具有较强的还原性,检验亚硫酸钠试样是否变质:

 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
【物质结构与性质】
过渡元素具有较多的空轨道,所以第四周期的Cr、Fe、Co、Ni、Cu、Zn等多种金属能形成配合物。
(1)基态Cu原子的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
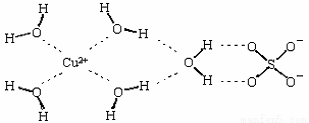
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4 易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
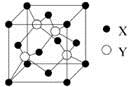
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子最外层电子数是其内层的3倍。X与Y所形成化合物晶体的晶胞如图所示,该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是 ;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 ;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下
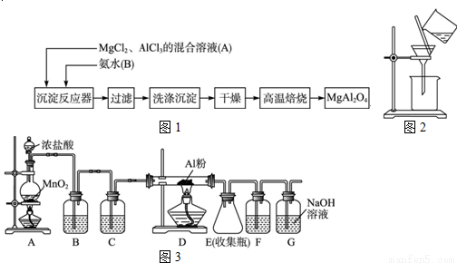
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如下图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 ,F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 ;
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子 层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由大到小的顺序为:Z>Y> W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
一氧化碳是一种用途相当广泛的化工基础原料。利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。 Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表
温度℃ | 25 | 80 | 230 |
平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
下列说法正确的是
A.上述反应是熵增反应
B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.25℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数是0.5
Ni(s)+4CO(g)的平衡常数是0.5
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:填空题
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为 。
(2)N、P、As原子的第一电离能由大到小的顺序为 。
(3)NH3的沸点比PH3 高,原因是 ;PO43-离子的立体构型为 。
高,原因是 ;PO43-离子的立体构型为 。
(4)PH3分子中P原子采用 杂化。
(5)H3AsO4和H3A sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6) CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:简答题
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质
都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更
高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
 ③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
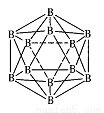
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原予(如图)
其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构
类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确
定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原
子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
下列图示与对应的叙述相符的是

A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化
B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强
C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com