





 ,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为
,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为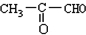 ,D为
,D为 ,E为
,E为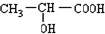 ,可发生缩聚反应生成G,以此解答该题.
,可发生缩聚反应生成G,以此解答该题. ,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为
,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为 ,D为
,D为 ,E为
,E为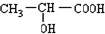 ,
, ,故答案为:
,故答案为: ;
; ,含有C=O和-COOH,可用红外光谱法测定官能团,E为
,含有C=O和-COOH,可用红外光谱法测定官能团,E为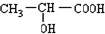 ,含有等官能团羧基、羟基,故答案为:红外光谱法;羧基、羟基;
,含有等官能团羧基、羟基,故答案为:红外光谱法;羧基、羟基; ,反应的方程式为
,反应的方程式为 ,
, .
.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
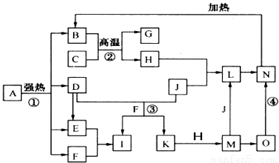
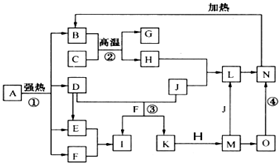 仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)请按要求回答:
| ||
. |
| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:

请按要求完成下列问题:
(1)L的化学式为___________。
(2)完成下列反应:
反应③的离子方程式:______________________________________________________,
反应④的化学方程式:______________________________________________________。
(3)反应②在工业生产上的用途是____________________________________________。
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 ________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
仔细阅读下图,已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。
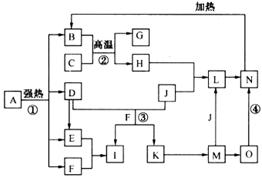
请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为 。
(2)写出反应②在工业生产上的一种用途: 。
(3)反应③的离子方程式为 ;
反应④的化学方程式为 。
(4)常以C或H制成容器盛装和运输I的浓溶液,其原理是
。
查看答案和解析>>
科目:高中化学 来源:2009-2010学年四川省眉山市仁寿县铧强中学高三(下)月考化学试卷(3月份)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com