
现有浓度为0.1 mol/L的五种电解质溶液
①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH
已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是________________(填编号)。
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是________(填编号)。
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是_______ _________(填编号)。
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,则该反应的离子方程式是__________________________________。
科目:高中化学 来源: 题型:
在一恒定的容器中充人2molA和lmolB发生反应:2A(g)+B(g)  xC(g)达到平衡 后,C的体积分数为α%;若维持容器的容积和温度不变,按起始物质的量A为0.6mol, B为0.3mol,C为1.4mol充入容器中,达到平衡后,C的体积分数仍为α%,则z的值为
xC(g)达到平衡 后,C的体积分数为α%;若维持容器的容积和温度不变,按起始物质的量A为0.6mol, B为0.3mol,C为1.4mol充入容器中,达到平衡后,C的体积分数仍为α%,则z的值为
A.只能为2 B.只能为3 C.可能为2,也可能为3 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是
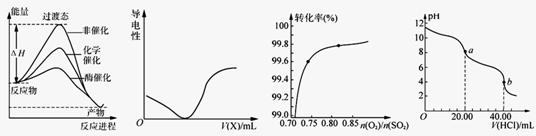
图1 图2 图3 图4
A.由图1所示曲线可知,化学催化比酶催化的效果好
B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
D.图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+ = CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,将稀氨水逐滴滴加到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A. c(NH4+)=c(SO42-) B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-) D. c(NH4+)+c(SO42-)= c(H+)=c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于0.1mol•L-1 Na2SO3溶液,正确的是
A、升高温度,溶液的pH降低
B、c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C、c(Na+)+c(H+)=2 c(SO32―)+ 2c(HSO3―)+ c(O H―)
H―)
D、加入少量NaOH固体,c(SO32―)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
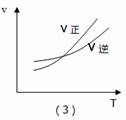
某化学科研小组研究合成氨:N2(g)+3H2(g)  2NH3(g);△H<0,在其他条件不变时,改变某一条件时对化学平衡的影响,得到如下图像,以下对应选项中正确的是( )
2NH3(g);△H<0,在其他条件不变时,改变某一条件时对化学平衡的影响,得到如下图像,以下对应选项中正确的是( )
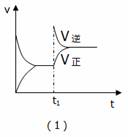


A.(1)对应的是:在t1时恒压条件下,通入NH3
B. (2)对应的是:氨气在恒容不同温度下的百分含量
(2)对应的是:氨气在恒容不同温度下的百分含量
C.(3)对应的是:在恒容条件下,反应速率与温度的关系
D.(4)对应的是:N2转化率与温度(T1>T2)、压强的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
 A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在人类社会发展中起着重要的作用,展望未来,化学科学具有十分广阔的探索空间。现代化学不涉及的研究领域是
A.开发新的能源 B.合成新的物质
C.空间形式和数量关系 D.防治环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在标准状况下,体积为11.2 L 的SO2的物质的量 mol、质量 g,其所含原子的总数是 ,所含O原子数为 。
(2)等物质的量O2和臭氧(O3),所含的分子数之比为 ,所含的氧原子数之比为 ,所含的质量之比为 。
(3)0.5mol H2SO4 的质量是______g,能和______molNaOH完全反应,该硫酸所含氢元素的质量与______mol H3PO4或标准状况下______L HCl中所含氢元素的质量相同.
(4)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是 g/mol; ACl的化学式是 。
(5)微粒AXn- 核外有18个电子,则它的核电荷数为 ,核内中子数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com