
| m |
| M |
| 4000 |
| 30 |
| ||
| 64g/mol |
| 25 |
| 12 |
| 25 |
| 12 |
| 25 |
| 12 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| KW/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
| 纯水 | 加少量盐酸 | 加少量NaOH | |
| c(H+) | 1.0×10-7 mol/L | 增大 | |
| c(OH-) | 1.0×10-7 mol/L | 增大 | |
| c(H+)和c(OH-)大小比较 | c(H+)=c(OH-) | c(H+) | c(H+) |
| 水的电离平衡移动方向 | |||
| KW值 | 1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
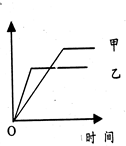 可用右侧示意图象表示的是( )
可用右侧示意图象表示的是( )| A、反应:等质量钾、钠分别与水反应,纵坐标:H 2质量,甲:钠,乙:钾 |
| B、反应:相同质量氨,在同一容器中2NH3?N2+3H2,纵坐标:氨气的转化率,甲:500℃,乙:400℃ |
| C、反应:体积比1:3的N2,H2,在体积可变的恒压容器中,2NH3?N2+3H2,纵坐标:氨气的浓度,甲:活性高的催化剂,乙:活性一般的催化剂 |
| D、反应:2mol S02与lmol 02,在相同温度下2S02+02?2S03,纵坐标:S03物质的量,甲:10atm,乙:2atm |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com