
【题目】在平衡体系Ca(OH)2(s) ![]() Ca2++2OH -中,能使c(Ca2+)减小,而使c(OH -)增大的是:( )
Ca2++2OH -中,能使c(Ca2+)减小,而使c(OH -)增大的是:( )
A.加入少量MgCl2固体B.加入少量Na2CO3固体
C.加入少量KCl固体D.加入少量Ca(OH)2固体
【答案】B
【解析】
A、镁离子结合氢氧根离子生成氢氧化镁沉淀,加入少量MgCl2固体, c(OH -)减小,Ca(OH)2(s) ![]() Ca2++2OH -平衡正向移动,c(Ca2+)增大,故不选A;
Ca2++2OH -平衡正向移动,c(Ca2+)增大,故不选A;
B、碳酸根离子结合钙离子生成碳酸钙沉淀,加入少量Na2CO3固体, c(Ca2+)减小,Ca(OH)2(s) ![]() Ca2++2OH -平衡正向移动,c(OH -)增大,故选B;
Ca2++2OH -平衡正向移动,c(OH -)增大,故选B;
C、加入少量KCl固体,Ca(OH)2(s) ![]() Ca2++2OH -平衡不移动,c(Ca2+)、c(OH -)不变,故不选C;
Ca2++2OH -平衡不移动,c(Ca2+)、c(OH -)不变,故不选C;
D、固体物质对平衡移动无影响,Ca(OH)2是固体,平衡体系Ca(OH)2(s) ![]() Ca2++2OH –不移动,c(Ca2+)、c(OH -)不变,故不选D;
Ca2++2OH –不移动,c(Ca2+)、c(OH -)不变,故不选D;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别是__、__(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)r(Li+)__r(H-),原因是___。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是__。中心原子的杂化形式为___。LiAlH4中,存在__(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图a的BornHaber循环计算得到。
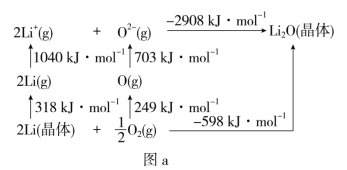
可知,Li原子的第一电离能为__kJ·mol-1,O=O键键能为__kJ·mol-1,Li2O晶格能为__kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图b所示,已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为___g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为综合利用高浓度磷复肥工业的副产品磷石膏![]() 主要成分为
主要成分为![]() ,进行的研究如下:
,进行的研究如下:
![]() 一定条件下,
一定条件下,![]() 的脱水反应相关的热化学方程式如下:
的脱水反应相关的热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
则该条件下反应![]() 的
的![]() ________
________![]() 。
。
![]() 作还原剂与磷石膏的反应为
作还原剂与磷石膏的反应为![]()
![]() 。向盛有
。向盛有![]() 的
的![]() 真空恒容密闭容器中充入
真空恒容密闭容器中充入![]() ,反应体系起始总压强为
,反应体系起始总压强为![]() ,在
,在![]() 下,固体物质的物质的量随时间变化的关系如图1所示。
下,固体物质的物质的量随时间变化的关系如图1所示。
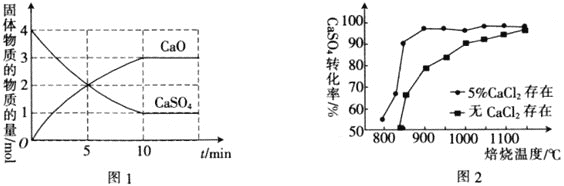
![]() 内,
内,![]() ________。
________。
![]() 达到平衡时,CO的转化率为________。
达到平衡时,CO的转化率为________。
![]() 该反应的压强平衡常数
该反应的压强平衡常数![]() ________
________![]() 用含a的代数式表示;用平衡分压代替平衡浓度计算,分压
用含a的代数式表示;用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 以高硫煤为还原剂焙烧磷石膏,可将
以高硫煤为还原剂焙烧磷石膏,可将![]() 还原,得到的
还原,得到的![]() 可用于工业生产硫酸。图2为熔烧
可用于工业生产硫酸。图2为熔烧![]() 小时内
小时内![]() 对硫酸钙转化率的影响图像,焙烧温度达到
对硫酸钙转化率的影响图像,焙烧温度达到![]() 之前,使用
之前,使用![]() 可以________
可以________![]() 填“提高”“降低”或“不影响”
填“提高”“降低”或“不影响”![]() 的转化率。
的转化率。
![]() 利用反应
利用反应![]() 可将磷石膏转化为硫酸铵。
可将磷石膏转化为硫酸铵。
![]() 已知:氨水
已知:氨水![]() ,碳酸
,碳酸![]() ,
,![]() 。则
。则![]() 溶液显________
溶液显________![]() 填“酸性”“碱性”或“中性”
填“酸性”“碱性”或“中性”![]() 。
。
![]() 的
的![]() 溶液显酸性的原因是________
溶液显酸性的原因是________![]() 用离子方程式表示
用离子方程式表示![]() ,溶液中
,溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列几组物质,请将序号填入下列空格内:
A、CH2=CH-COOH和油酸(C17H33COOH) B、12C60和石墨 C、![]() 和
和![]() D、35Cl和37Cl E、乙醇和乙二醇
D、35Cl和37Cl E、乙醇和乙二醇
①互为同系物的是________;
②互为同分异构体的是________;
③既不是同系物,又不是同分异构体,也不是同素异形体,但可看成是同一类物质的是________。
(2)有8种物质:A乙烷;B乙烯;C乙炔;D苯;E甲苯;F溴乙烷;G聚丙烯;H环己烯。
其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是________;
(3)写出![]() 聚合物的单体结构简式________和________。
聚合物的单体结构简式________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁元素位于元素周期表中第______周期,第______族;
(2)Fe3+的电子排布式______
(3)Fe2+的外围电子轨道表示式______
(4)为什么Fe3+在自然界Fe的各种存在形式中最为常见?______
(5)目前发现的铁的最高化合价是+6价,理论上最高价是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是
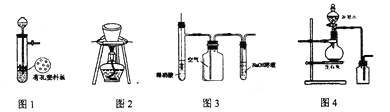
A. 图1所示装置用于Cu和浓硫酸反应制取少量的SO2气体
B. 图2装置用于除去碳酸氢钠固体中的少量碳酸钠
C. 图3装置用于制备并收集NO气体
D. 图4所示装置制取并收集氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述正确的有几个( )
①用浓氨水清洗做过制备AgCl反应后的试管;②配制一定物质的量浓度的溶液时,未振荡摇匀则溶液浓度偏高;③用湿润的pH试纸测定稀盐酸的pH;④用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液;⑤将Na2CO3固体在瓷坩埚中加热熔融;⑥不慎将苯酚溶液沾到皮肤上,立即用NaOH稀溶液清洗;⑦向沸腾的NaOH溶液中滴加FeCl3溶液制备Fe(OH)3胶体;⑧配制FeSO4溶液时,需加入少量铁粉和稀盐酸
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备 NO气体及硝酸铜晶体[Cu(NO3)2·3H2O],需经过铜与稀硝酸反应、收集 NO、尾气处理、制取硝酸铜晶体四个步骤,下列图示装置和原理能达到实验目的的是
A.用装置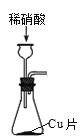 制取
制取 ![]() 和 NO
和 NO
B.用装置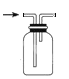 收集 NO
收集 NO
C.用装置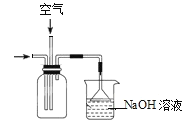 吸收尾气
吸收尾气
D.用装置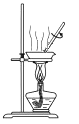 蒸干溶液制 Cu(NO3)2·3H2O
蒸干溶液制 Cu(NO3)2·3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com