
ΓΨΧβΡΩΓΩ(1)”–œ¬Ν–ΦΗΉιΈο÷ Θ§«κΫΪ–ρΚ≈Χν»κœ¬Ν–Ω’ΗώΡΎΘΚ
AΓΔCH2=CH-COOHΚΆ”ΆΥα(C17H33COOH) BΓΔ12C60ΚΆ ·ΡΪ CΓΔ![]() ΚΆ
ΚΆ![]() DΓΔ35ClΚΆ37Cl EΓΔ““¥ΦΚΆ““Εΰ¥Φ
DΓΔ35ClΚΆ37Cl EΓΔ““¥ΦΚΆ““Εΰ¥Φ
ΔΌΜΞΈΣΆ§œΒΈοΒΡ «________ΘΜ
ΔΎΜΞΈΣΆ§Ζ÷“λΙΙΧεΒΡ «________ΘΜ
ΔέΦ»≤Μ «Ά§œΒΈοΘ§”÷≤Μ «Ά§Ζ÷“λΙΙΧεΘ§“≤≤Μ «Ά§ΥΊ“λ–ΈΧεΘ§ΒΪΩ…Ω¥≥… «Ά§“ΜάύΈο÷ ΒΡ «________ΓΘ
(2)”–8÷÷Έο÷ ΘΚA““ΆιΘΜB““œ©ΘΜC““»≤ΘΜD±ΫΘΜEΦΉ±ΫΘΜFδε““ΆιΘΜGΨέ±ϊœ©ΘΜHΜΖΦΚœ©ΓΘ
Τδ÷–Φ»≤ΜΡή ΙΥα–‘KMnO4»ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΒΡ «________ΘΜ
(3)–¥≥ω![]() ΨέΚœΈοΒΡΒΞΧεΫαΙΙΦρ Ϋ________ΚΆ________ΓΘ
ΨέΚœΈοΒΡΒΞΧεΫαΙΙΦρ Ϋ________ΚΆ________ΓΘ
ΓΨ¥πΑΗΓΩA C E ADFG CH2=CH2 CH2=CHCH3
ΓΨΫβΈωΓΩ
±ΨΧβΩΦ≤ιΝΥΆ§œΒΈοΓΔΆ§Ζ÷“λΙΙΧεΓΔΆ§άύΈο÷ ΒΡ≈–ΕœΓΔ≥ΘΦϊ”–ΜζΈοΒΡœύΙΊ–‘÷ ΚΆΨέΚœΈοΒΞΧεΒΡ ι–¥Θ§Ρ―Ε»÷–Β»Θ§’ΤΈ’Μυ¥ΓΈΣΫβΧβΙΊΦϋΘ§ΉΔ“βΜυ¥Γ÷Σ ΕΒΡΜΐάέ
(1)AΘ°CH2=CH-COOHΚΆ”ΆΥα(C17H33COOH)ΫαΙΙœύΥΤΓΔΆ® ΫœύΆ§Θ§œύ≤ν15ΗωCH2‘≠Ή”Ά≈Θ§ΜΞΈΣΆ§œΒΈοΘΜ
B.C60ΚΆ ·ΡΪ «”…ΧΦ‘ΣΥΊΉι≥…ΒΡ≤ΜΆ§ΒΞ÷ Θ§ΜΞΈΣΆ§ΥΊ“λ–ΈΧεΘΜ
C.![]() Ζ÷Ή” ΫœύΆ§Θ§ΫαΙΙ≤ΜΆ§Θ§ΜΞΈΣΆ§Ζ÷“λΙΙΧεΘΜ
Ζ÷Ή” ΫœύΆ§Θ§ΫαΙΙ≤ΜΆ§Θ§ΜΞΈΣΆ§Ζ÷“λΙΙΧεΘΜ
D.![]() ΚΆ
ΚΆ![]() ÷ Ή” ΐΕΦΈΣ17Θ§÷–Ή” ΐ≤ΜΆ§Θ§ «¬»‘ΣΥΊΒΡ≤ΜΆ§‘≠Ή”Θ§ΜΞΈΣΆ§ΈΜΥΊΘΜ
÷ Ή” ΐΕΦΈΣ17Θ§÷–Ή” ΐ≤ΜΆ§Θ§ «¬»‘ΣΥΊΒΡ≤ΜΆ§‘≠Ή”Θ§ΜΞΈΣΆ§ΈΜΥΊΘΜ
E.““¥ΦΚΆ““Εΰ¥ΦΕΦΚ§”–τ«ΜυΒΪΗω ΐ≤ΜΆ§Θ§Ω…Ω¥≥… «Ά§“ΜάύΈο÷ ΓΘ
Ήέ…œΩ…÷ΣΘ§ΔΌΜΞΈΣΆ§œΒΈοΒΡ «AΘΜΔΎΜΞΈΣΆ§Ζ÷“λΙΙΧεΒΡ «CΘΜΔέΦ»≤Μ «Ά§œΒΈοΘ§”÷≤Μ «Ά§Ζ÷“λΙΙΧεΘ§“≤≤Μ «Ά§ΥΊ“λ–ΈΧεΘ§ΒΪΩ…Ω¥≥… «Ά§“ΜάύΈο÷ ΒΡ «EΘ§
Ι ¥πΑΗΈΣΘΚΔΌAΘΜΔΎCΘΜΔέEΘΜ
(2)A““ΆιΦ»≤ΜΡή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
B.““œ©Φ»Ρή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤Ρή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§“≤Ρή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
C.““»≤Φ»Ρή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤Ρή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§“≤Ρή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
D.±ΫΦ»≤ΜΡή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
E.ΦΉ±ΫΡή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§ΒΪ≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§ΒΪ≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
F.δε““ΆιΦ»≤ΜΡή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
G.Ψέ±ϊœ©Φ»≤ΜΡή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
H.ΜΖΦΚœ©Φ»Ρή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤Ρή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
»ή“ΚΆ …ΪΘ§“≤Ρή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΘΜ
Ήέ…œΩ…÷ΣΘ§≤ΜΡή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΒΡ «ADFGΘ§
»ή“ΚΆ …ΪΘ§“≤≤ΜΡή”κδεΥ°Ζ¥”Π ΙδεΥ°Ά …ΪΒΡ «ADFGΘ§
Ι ¥πΑΗΈΣΘΚADFGΘΜ
(3)Ν¥ΫΎ÷ςΝ¥…œ÷Μ”–ΧΦ‘≠Ή”≤Δ¥φ‘ΎΧΦΧΦΥΪΦϋΫαΙΙΒΡΗΏΨέΈοΘ§ΤδΙφ¬… «ΓΑΦϊΥΪΦϋΘ§ΥΡΗωΧΦΘ§ΈόΥΪΦϋΘ§ΝΫΗωΧΦΓ±Μ≠œΏΕœΩΣΘ§»ΜΚσΫΪΑκΦϋ±’ΚœΘ§Φ¥ΫΪΒΞΥΪΦϋΜΞΜΜΘ°ΫαΙΙΦρ Ϋ÷–÷ςΝ¥…œ”–4ΗωΧΦ‘≠Ή”ΤδΒΞΧε±ΊΈΣ2÷÷Θ§ΫΪΒΞΦϋΦϋ÷–ΒΡ1ΗωC-C¥ρΩΣΘ§Ω…ΒΟΗΟΨέΚœΈοΒΡΒΞΧεΫαΙΙΦρ ΫΈΣCH2=CH2ΚΆ CH2=CHCH3Θ§
Ι ¥πΑΗΈΣΘΚCH2=CH2;CH2=CHCH3


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕ‘”Ύ‘ΎΟή±’»ίΤς÷–Ϋχ––ΒΡΩ…ΡφΖ¥”Π![]() Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
A.»ίΤςΡΎ÷ΜΚ§”–![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() »ΐ÷÷Ζ÷Ή”
»ΐ÷÷Ζ÷Ή”
B.![]() ÷Μ¥φ‘Ύ
÷Μ¥φ‘Ύ![]() Ζ÷Ή”÷–
Ζ÷Ή”÷–
C.»ίΤςΡΎΚ§”–![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() Β»Ζ÷Ή”
Β»Ζ÷Ή”
D.Ζ¥”Π¥οΒΫœόΕ» ±Θ§Υυ”–Έο÷ ΒΡ÷ ΝΩΕΦœύΒ»
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“Β…œΓΑΙΧΕ®Γ±ΚΆάϊ”ΟCO2Ρή”––ßΒΊΦθ«αΓΑΈ¬ “–ß”ΠΓ±ΓΘ
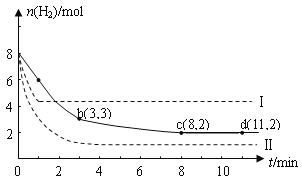
IΘ°ΙΛ“Β…œ’ΐ‘Ύ―–ΨΩάϊ”ΟCO2ά¥…ζ≤ζΦΉ¥Φ»ΦΝœΒΡΖΫΖ®Θ§ΗΟΖΫΖ®ΒΡΜ·―ßΖΫ≥Χ Ϋ «ΘΚCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΓςH=-49.0kJmol©¹1Θ§Ρ≥ΩΤ―ß Β―ιΫΪ6molCO2ΚΆ8 molH2≥δ»κ“Μ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–(Έ¬Ε»±Θ≥÷≤Μ±δ)Θ§≤βΒΟH2ΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·»γœ¬ΆΦ÷– ΒœΏΥυ ΨΘ®ΆΦ÷–Ή÷ΡΗΚσΒΡ ΐΉ÷±μ ΨΕ‘”ΠΒΡΉχ±ξΘ©ΘΚ
CH3OH(g)+H2O(g) ΓςH=-49.0kJmol©¹1Θ§Ρ≥ΩΤ―ß Β―ιΫΪ6molCO2ΚΆ8 molH2≥δ»κ“Μ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–(Έ¬Ε»±Θ≥÷≤Μ±δ)Θ§≤βΒΟH2ΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·»γœ¬ΆΦ÷– ΒœΏΥυ ΨΘ®ΆΦ÷–Ή÷ΡΗΚσΒΡ ΐΉ÷±μ ΨΕ‘”ΠΒΡΉχ±ξΘ©ΘΚ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©“‘œ¬ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ®__________Θ©
AΘ°0ΓΪ1minΒΡΤΫΨυΖ¥”ΠΥΌ¬ ¥σ”Ύ3ΓΪ4minΒΡΤΫΨυΖ¥”ΠΥΌ¬
BΘ°¥οΒΫΤΫΚβ ±H2ΒΡΉΣΜ·¬ ΈΣ75%
CΘ° ‘ΎΤδΥϋΧθΦΰ≤Μ±δ ±Θ§»τΧαΗΏΖ¥”ΠΒΡΈ¬Ε»’ΐΖ¥”ΠΥΌ¬ ‘ω¥σΘ§ΡφΖ¥”ΠΥΌ¬ Φθ–Γ
Θ®2Θ©ΗΟΖ¥”Π‘Ύ0 ΓΪ8 minΡΎCO2ΒΡΤΫΨυΖ¥”ΠΥΌ¬ «_______ΓΘ
Θ®3Θ©ΗΟΖ¥”ΠΒΡΤΫΫ÷≥Θ ΐK=______________ΓΘ
Θ®4Θ©ΫωΗΡ±δΡ≥“ΜΧθΦΰ‘ΌΫχ–– Β―ιΘ§≤βΒΟH2ΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·»γΆΦ÷––ιœΏΥυ ΨΓΘ”κ ΒœΏœύ±»Θ§–ιœΏIΗΡ±δΒΡΧθΦΰΩ…Ρή «_________ΓΘ»τ ΒœΏΕ‘”ΠΧθΦΰœ¬ΤΫΚβ≥Θ ΐΈΣKΘ§–ιœΏIΕ‘”ΠΧθΦΰœ¬ΤΫΚβ≥Θ ΐΈΣK1Θ§–ιœΏIIΕ‘”ΠΧθΦΰœ¬ΤΫΚβ≥Θ ΐΈΣK2Θ§‘ρKΓΔK1ΚΆK2ΒΡ¥σ–ΓΙΊœΒ «____ΓΘ
IIΘ°ΦΚ÷Σ25Γφ ±Θ§““ΥαΚΆΧΦΥαΒΡΒγάκΤΫΚβ≥Θ ΐ»γœ¬±μΘΚ
Έο÷ ΒΡΜ·―ß Ϋ | CH3COOH | H2CO3 | |
ΒγάκΤΫΚβ≥Θ ΐ | K=1.8ΓΝ10Θ≠5 | K1=4.3ΓΝ10Θ≠7 | K2=5.6ΓΝ10Θ≠11 |
Θ®1Θ©”Ο±ΞΚΆΑ±Υ°Έϋ ’CO2Ω…ΒΟΒΫNH4HCO3»ή“ΚΘ§»τ“―÷ΣCH3COONH4»ή“ΚpH=7Θ§‘ρ(NH4)2CO3»ή“Κœ‘_____(ΧνΓΑΥα–‘Γ±ΓΔΓΑΦν–‘Γ±ΜρΓΑ÷––‘Γ±)ΓΘ
Θ®2Θ©25Γφ ±Θ§‘Ύ0Θ°lmolL©¹1““Υα»ή“Κ÷–Φ”»κ“ΜΕ®ΝΩΒΡNaHCO3Θ§±Θ≥÷Έ¬Ε»≤Μ±δΘ§ΥυΒΟΜλΚœ“ΚΒΡpH=6Θ§Ρ«Ο¥ΜλΚœ“Κ÷–![]() =_______ΘΜΗΟΜλΚœ»ή“Κ÷–ΒΡάκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣΘΚ________________ΓΘ
=_______ΘΜΗΟΜλΚœ»ή“Κ÷–ΒΡάκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣΘΚ________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Έο÷ ‘ΎΗχΕ®ΧθΦΰœ¬ΒΡΆ§Ζ÷“λΙΙΧε ΐΡΩ’ΐ»ΖΒΡ «(ΓΓΓΓ)
A. C4H10 τ”ΎΆιΧΰΒΡΆ§Ζ÷“λΙΙΧε”–3÷÷
B. Ζ÷Ή”Ήι≥… «C5H10O2 τ”Ύτ»ΥαΒΡΆ§Ζ÷“λΙΙΧε”–5÷÷
C. Ζ÷Ή”Ήι≥… «C4H8O τ”Ύ»©ΒΡΆ§Ζ÷“λΙΙΧε”–3÷÷
D. ΫαΙΙΦρ ΫΈΣ![]() ΒΡ“Μδε¥ζΈο”–5÷÷
ΒΡ“Μδε¥ζΈο”–5÷÷
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΡ≥άκΉ”ΨßΧεΨßΑϊ»γœ¬ΆΦΥυ ΨΘ§ΤδΡΠΕϊ÷ ΝΩΈΣMΘ§ΑΔΖϋΦ”Β¬¬ό≥Θ ΐΈΣNAΘ§ΨßΧεΒΡΟήΕ»ΈΣd g/cm3ΓΘœ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «

A. ΨßΧεΨßΑϊ÷–“θΓΔ―τάκΉ”ΒΡΗω ΐΕΦΈΣ1
B. ΗΟΨßΧε÷–ΝΫΗωΨύάκΉνΫϋΒΡΆ§÷÷άκΉ”ΒΡΚΥΦδΨύΈΣ![]() cm
cm
C. Τδ÷–“θΓΔ―τάκΉ”ΒΡ≈δΈΜ ΐΕΦ «4
D. ΗΟΨßΑϊΩ…Ρή «NaClΒΡΨßΑϊ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–≥¬ ω÷–Θ§ΔώΓΔΔρΕΦ’ΐ»Ζ«“ΝΫ’ΏΦδΨΏ”–“ρΙϊΙΊœΒΒΡ“ΜΉι «![]()
―Γœν | ≥¬ ωΔώ | ≥¬ ωΔρ |
A |
| Βψ»ΦΒΡMgΧθΡή‘Ύ |
B |
| Ω…”Ο÷ΊΫαΨßΖ®≥ΐ»Ξ |
C |
| ”Ο≈≈±ΞΚΆ ≥―ΈΥ°ΒΡΖ® ’Φ· |
D |
| ≤ΜΡή”Ο’τΗ… |
A.AB.BC.CD.D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΤΫΚβΧεœΒCa(OH)2(s) ![]() Ca2++2OH -÷–Θ§Ρή Ιc(Ca2+)Φθ–ΓΘ§Εχ Ιc(OH -)‘ω¥σΒΡ «ΘΚΘ® Θ©
Ca2++2OH -÷–Θ§Ρή Ιc(Ca2+)Φθ–ΓΘ§Εχ Ιc(OH -)‘ω¥σΒΡ «ΘΚΘ® Θ©
A.Φ”»κ…ΌΝΩMgCl2ΙΧΧεB.Φ”»κ…ΌΝΩNa2CO3ΙΧΧε
C.Φ”»κ…ΌΝΩKClΙΧΧεD.Φ”»κ…ΌΝΩCa(OH)2ΙΧΧε
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΘΚ![]() ±Θ§
±Θ§![]() Θ§
Θ§![]() Θ§
Θ§![]() Θ§
Θ§![]() Θ§
Θ§![]() ΓΘ
ΓΘ
![]() »ή“ΚΚΆNaHA»ή“ΚΖ¥”ΠΒΡ÷ς“ΣάκΉ”ΖΫ≥Χ ΫΈΣ________________________________
»ή“ΚΚΆNaHA»ή“ΚΖ¥”ΠΒΡ÷ς“ΣάκΉ”ΖΫ≥Χ ΫΈΣ________________________________![]() ≤ΜΩΦ¬«
≤ΜΩΦ¬«![]() ”κ
”κ![]() ΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”Π
ΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”Π![]() ΓΘ
ΓΘ
![]() »ή“Κ÷–άκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣ ____________________________ΓΘ
»ή“Κ÷–άκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣ ____________________________ΓΘ
![]() ±Θ§ΫΪ
±Θ§ΫΪ![]() ΒΡHCOOH»ή“ΚΚΆ
ΒΡHCOOH»ή“ΚΚΆ![]() ΒΡ
ΒΡ![]() »ή“ΚΖ÷±π”κ
»ή“ΚΖ÷±π”κ![]() ΒΡ
ΒΡ![]() »ή“ΚΜλΚœΘ§ Β―ι≤βΒΟ≤ζ…ζΒΡΤχΧεΧεΜΐ
»ή“ΚΜλΚœΘ§ Β―ι≤βΒΟ≤ζ…ζΒΡΤχΧεΧεΜΐ![]() Υφ ±Φδ
Υφ ±Φδ![]() ±δΜ·ΒΡ Ψ“βΆΦ»γΆΦΥυ ΨΘΚ
±δΜ·ΒΡ Ψ“βΆΦ»γΆΦΥυ ΨΘΚ
![]() ΒΡΒγάκΤΫΚβ≥Θ ΐ±μ¥ο Ϋ
ΒΡΒγάκΤΫΚβ≥Θ ΐ±μ¥ο Ϋ![]() __________________________ΓΘ
__________________________ΓΘ
![]() Ζ¥”Π≥θ ΦΫΉΕΈΘ§ΝΫ÷÷»ή“Κ≤ζ…ζ
Ζ¥”Π≥θ ΦΫΉΕΈΘ§ΝΫ÷÷»ή“Κ≤ζ…ζ![]() ΤχΧεΒΡΥΌ¬ ¥φ‘ΎΟςœ‘≤ν“λΒΡ‘≠“ρ «__________________________________________________________________________________Θ§Ζ¥”ΠΫα χΚσΥυΒΟΝΫ»ή“Κ÷–Θ§
ΤχΧεΒΡΥΌ¬ ¥φ‘ΎΟςœ‘≤ν“λΒΡ‘≠“ρ «__________________________________________________________________________________Θ§Ζ¥”ΠΫα χΚσΥυΒΟΝΫ»ή“Κ÷–Θ§![]() ____________
____________![]() ΧνΓΑ
ΧνΓΑ![]() Γ±ΓΑ
Γ±ΓΑ![]() Γ±ΜρΓΑ
Γ±ΜρΓΑ![]() Γ±
Γ±![]() ΓΘ
ΓΘ
![]() ±Θ§Ρ≥»ή“Κ÷–Κ§”–
±Θ§Ρ≥»ή“Κ÷–Κ§”–![]() ΓΔ
ΓΔ![]() Φ”»κKOHΙΧΧε“‘ΒςΫΎ»ή“Κ
Φ”»κKOHΙΧΧε“‘ΒςΫΎ»ή“Κ![]() Κω¬‘»ή“ΚΧεΜΐΒΡ±δΜ·ΓΔΚω¬‘
Κω¬‘»ή“ΚΧεΜΐΒΡ±δΜ·ΓΔΚω¬‘ ![]() ΒΡΜ”ΖΔΚΆΖ÷Ϋβ
ΒΡΜ”ΖΔΚΆΖ÷Ϋβ![]() ΓΘΒ±pHΈΣ7 ±Θ§ΡήΖώ”–
ΓΘΒ±pHΈΣ7 ±Θ§ΡήΖώ”–![]() ≥ΝΒμ…ζ≥…ΘΩ________
≥ΝΒμ…ζ≥…ΘΩ________![]() ΧνΓΑΡήΓ±ΜρΓΑΖώΓ±
ΧνΓΑΡήΓ±ΜρΓΑΖώΓ±![]() ΓΘ
ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν– Β―ι≤ΌΉς”κΑ≤»Ϊ ¬Ι ¥Πάμ’ΐ»ΖΒΡ «
A.≥ΐ»ΞKCl»ή“Κ÷–ΒΡ…ΌΝΩMgCl2ΘΚΦ”»κ ΝΩNaOH»ή“ΚΘ§Ιΐ¬Υ
B.Α―≤ΘΝßΙή≤ε»κœπΫΚ»ϊΩΉ ±Θ§”ΟΚώ≤ΦΜΛ ÷Θ§ΫτΈ’”ΟΥ° Σ»σΒΡ≤ΘΝßΙή≤ε»κΕΥΘ§ΜΚ¬ΐ–ΐΫχ»ϊΩΉ
C.”Ο ‘ΙήΦ–¥” ‘ΙήΒΉ”…œ¬Άυ…œΦ–ΉΓΨύάκΙήΩΎ‘Φ![]() ¥ΠΘ§ ÷≥÷ ‘ΙήΦ–≥Λ±ζΡ©ΕΥΘ§Ϋχ––Φ”»»
¥ΠΘ§ ÷≥÷ ‘ΙήΦ–≥Λ±ζΡ©ΕΥΘ§Ϋχ––Φ”»»
D.”ΟΒψ»ΦΒΡΜπ≤ώ‘Ύ“ΚΜ·ΤχΗ÷ΤΩΩΎΦλ―ι «Ζώ¬©Τχ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com