
 Na2S(s)+4H2O(g),并达到平衡。请完成下列各题:
Na2S(s)+4H2O(g),并达到平衡。请完成下列各题: 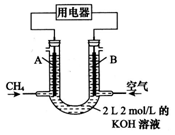
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
(2010?广州二模)I2在KI溶液中存在下列平衡:I2(aq)+I-?I3-(aq).测得不同温度下该反应的平衡常数K如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263.
I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263.查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省衡水中学高一下学期二调化学试卷(带解析) 题型:填空题
I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ | 元素编号[来源:学*科*网Z*X*X*K] | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 | | +5 | | +7 |
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
查看答案和解析>>
科目:高中化学 来源:2013届陕西省咸阳市高二上学期期中考试化学试卷 题型:选择题
I2在KI溶液中存在下列平衡:I2(aq) + I-(aq)  I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
|
t/℃ |
5 |
15 |
25 |
35 |
50 |
|
K |
1100 |
841 |
680 |
533 |
409 |
下列说法正确的是:
A.反应I2(aq)+I-(aq)  I3-(aq)的△H>0
I3-(aq)的△H>0
B. 其他条件不变,加入KI固体平衡向正反应方向移动,所以溶液中c(I-)减小
C. 其他条件不变,升高温度,溶液中c(I3-)减小
D.25℃时,向溶液中加入少量KI固体,平衡正向移动,平衡常数K会大于680
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com