
【题目】化学来源于生活又服务于生活,化工生产是指对原料进行化学加工,最终获得有价值的产品的生产过程。某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红(氧化铁)和硫酸铵晶体。流程如下:
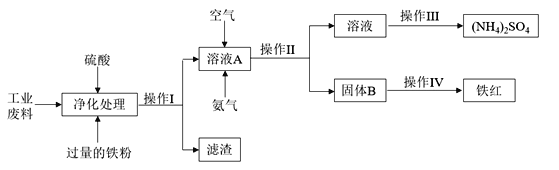
请回答下列问题:
(1)操作I的名称________________,滤渣的成分为__________________。
(2)简述下列实验操作:
①检验溶液A中金属阳离子的方法为____________________________________________________;
②检验固体B是否洗涤干净的方法是____________________________________________________。
(3)请写出溶液A中反应的离子方程式_______________________________________________________
(4) 测定废料中硫酸铜的质量分数:称取a g废料样品,将操作I得到的滤渣用足量的稀硫酸溶解、过滤、洗涤、干燥,称得固体的质量为b g,则废料中硫酸铜的质量分数为_______________(写出表达式。)
(5) 某同学提出另一种制备铁红的方法:往工业废水中加入足量的硫酸和双氧水,通过下列操作也可以得到铁红,请配平下列离子方程式_____ Fe2++ _____ H2O2 + _____ H+= _____ Fe3+ + ____ H2O
【答案】过滤 Fe Cu 取少量液体于试管中,滴加少量的酸性高锰酸钾溶液,若高锰酸钾的紫红色褪去,证明含有Fe2+ ;取最后一次洗涤液少许于试管中,加入氯化钡溶液,若无白色沉淀生成,则已洗涤干净 10H2O+ 8NH3 +O2 + 4Fe2+ = 4 Fe(OH)3 + 8NH4+ (5b/2a)×100% 2 1 2 2 2
【解析】
硫酸亚铁和硫酸铜中加入硫酸和过量的铁粉,铁和硫酸铜反应置换出铜,所以溶液A为硫酸亚铁,滤渣为铁和铜。溶液A中通入氨气和氧气,硫酸亚铁和氨气和氧气反应生成氢氧化铁和硫酸铵,固体B为氢氧化铁,氢氧化铁固体加热得到氧化铁。
硫酸亚铁和硫酸铜中加入硫酸和过量的铁粉,铁和硫酸铜反应置换出铜,所以溶液A为硫酸亚铁,滤渣为铁和铜。溶液A中通入氨气和氧气,硫酸亚铁和氨气和氧气反应生成氢氧化铁和硫酸铵,固体B为氢氧化铁,氢氧化铁固体加热得到氧化铁。
(1)操作I是分离固体和液体,所以为过滤; 滤渣为Fe和Cu;
(2) ①溶液A中的阳离子为亚铁离子,可以利用其还原性,使用酸性高锰酸钾溶液进行检验,操作为:取少量液体于试管中,滴加少量的酸性高锰酸钾溶液,若高锰酸钾的紫红色褪去,证明含有Fe2+ ;
②固体B为氢氧化铁,可能吸附有硫酸根离子,所以检验固体是否洗净,就是检验最后一次的洗涤液是否含有硫酸根离子,操作方法为:取最后一次洗涤液少许于试管中,加入氯化钡溶液,若无白色沉淀生成,则已洗涤干净 ;
(3)硫酸亚铁和氨气和氧气反应生成硫酸铵和氢氧化铁沉淀,离子方程式为:10H2O+ 8NH3 +O2 + 4Fe2+ = 4 Fe(OH)3 + 8NH4+ ;
(4)操作I得到的滤渣为铁和铜,用足量的硫酸溶解后,得到的固体为铜,则根据硫酸铜和铜的关系分析,铜的质量为bg,则硫酸铜的质量为![]() g=5b/2g,硫酸铜的质量分数为(5b/2a)×100% ;
g=5b/2g,硫酸铜的质量分数为(5b/2a)×100% ;
(5) 反应中亚铁离子的化合价从+2价升高到+3价,改变1价,过氧化氢中的氧元素的化合价从-1降低到-2价,所以二者的比例为2:1,再根据原子守恒和电荷守恒配平,该离子方程式为:2Fe2++ H2O2 + 2H+= 2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,氯离子浓度最大的是( )
A.1L 1mol/L NaCl溶液B.2L 1mol/L KCl溶液
C.3L 1mol/L AlCl3溶液D.1L 2mol/L NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是
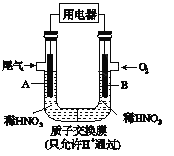
A. 电极A表面反应之一为NO2-e-+H2O= NO3_+2H+
B. 电极B附近的c(NO3_)增大
C. 电解质溶液中电流的方向由B到A,电子的流向与之相反
D. 该电池工作时,每转移4mol电子,消耗22.4L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 1molCO2与SO3的混合气体氧原子数为2NA
B. 1mol/L KClO3溶液中含有NA个ClO3﹣
C. 标准状况下,11.2LCCl4所含的分子数为0.5NA
D. 25℃,1.01×105Pa,88gCO2中所含原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的检验方法正确的是( )
A. 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO![]()
B. 将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有NH![]()
C. 向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含有CO![]() 或HCO
或HCO![]()
D. 某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在):
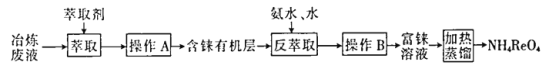
回答下列问题:
(1)NH4ReO4(高铼酸铵)中铼元素化合价为_________________。
(2)操作A的名称是_____________。
“萃取”中萃取剂应具有的性质:______(填代号)。
①萃取剂难溶于水 ②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度 ④萃取剂不和ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高温下高铼酸铵分解生成Re2O7,用氢气还原Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成Re2O7的化学方程式_____________________。
②工业上,利用氢气还原Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,其原因是_____________________。
(5)工业上,高温灼烧含ReS2的矿粉,可以制备R2O7。以含ReS2的矿石原料生产48.4tRe2O7,理论上转移__________mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com