
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)═CO2(g)△H1 C(s)+ ![]() O2(g)═CO(g)△H2 , 则△H2>△H1
O2(g)═CO(g)△H2 , 则△H2>△H1
C.已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
【答案】B
【解析】解:A.已知C(石墨,s)═C(金刚石,s)△H>0,石墨能量小于金刚石,则金刚石比石墨活泼,石墨比金刚石稳定,故A错误;
B.己知2C(s)+2O2(g)═2CO2(g)△H1、2C(s)+O2(g)═2CO(g)△H2,一氧化碳转化为二氧化碳是放热过程;焓变包含负号,则△H1<△H2,故B正确;
C.氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol,气态水不是稳定氧化物,2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1,则燃烧热> ![]() =241.8kJmol﹣1,故C错误;
=241.8kJmol﹣1,故C错误;
D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJmol﹣1,中和热指1molNaOH和molHCl溶液发生中和反应生成1mol水时所放出的热量为57.4 kJ,则0.5molNaOH与强酸,中和热不变,中和热为△H=﹣57.4 kJmol﹣1,故D错误;
故选:B.
A.物质能量越高越不稳定,△H>0表示正反应吸热;
B.一氧化碳转化为二氧化碳是放热过程;焓变包含负号;
C.燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,气态水不是稳定氧化物;
D.中和热为△H=﹣57.3 kJ/mol,是一个固定值;


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________; 人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag铁和氧化铁的混合物加入800mL0.1mol/L 的盐酸中充分反应后,盐酸全部消耗,放出标准状兄下气体0.224L。则下列判断中正确的是 ( )
A. 原混合物中n (Fe) :n (Fe2O3) =2: 1 B. 向溶液中滴入KSCN 溶液,显血红色
C. 无法计算出原混合物的质量 D. 此混合物中铁元素的质量分数为68.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 同一生物体不同组织细胞内化学元素种类大体相同
B. C、H、O、N是组成生物体内抗体所必需的元素
C. 蛋白质中的S元素存在于氨基酸的R基中
D. 核酸中的N存在于碱基中,蛋白质中的N主要存在于羧基中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、科技、环境等密切相关,下列说法正确的是:
A. 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸
B. 可以用氢氧化钠鉴别地沟油和矿物油
C. 用漂白精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更好
D. 明矾可以用于海水提纯制淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是
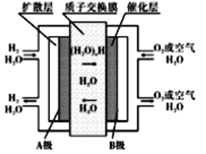
A. 可用一氧化碳代替图中氢气形成质子交换膜燃料电池
B. B极的电极反应式为O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole-时,通过质子交换膜的H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号_________, 元素⑥的原子结构示意图____________________。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________, 该化合物中含有的化学键是_____________________。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________(写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
Ⅳ | |
4 | Ge |
5 | Sn |
6 | Pb |
请解释产生上述性质变化的原因______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )

A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同主族元素随着原子序数的递增,下列说法正确的是
A.单质熔沸点逐渐降低B.金属单质的还原性逐渐减弱
C.原子半径逐渐增大D.元素的非金属性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com