
【题目】从废钒催化剂中回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:
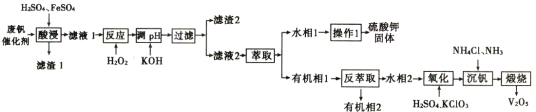
已知:①废钒催化剂中含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等。
②“酸浸”时V2O5和V2O4先与稀H2SO4反应分别生成![]() 和VO2+。
和VO2+。
③有机萃取剂萃取VO2+的能力比萃取![]() 的能力强。
的能力强。
④溶液中![]() 与
与![]() 可相互转化:
可相互转化:![]() 。
。
(1)为了提高“酸浸”效率可采取得措施为______________________。
(2)“酸浸”时加入FeSO4目的是___________,FeSO4参与反应的化学方程式为__________。
(3)“滤渣2”的成分为______________;“操作1”的名称为_______________。
(4)在“氧化”步骤中氧化剂与还原剂的物质的质量之比为1:6,反应的离子方程式为_________________________________________。
(5)t℃时,“氧化”后溶液中c(![]() )=0.1mol/L,假设“沉钒”步骤中
)=0.1mol/L,假设“沉钒”步骤中![]() 全部转化
全部转化![]() ,并生成NH4VO3沉淀,为使沉钒效率达到95%.则此时溶液中c(
,并生成NH4VO3沉淀,为使沉钒效率达到95%.则此时溶液中c(![]() )≥______________。[已知t℃时Ksp(NH4VO3)=2.0×10-3,反应前后溶液的体积变化忽略不计]
)≥______________。[已知t℃时Ksp(NH4VO3)=2.0×10-3,反应前后溶液的体积变化忽略不计]
(6)取“煅烧”后的V2O5样品m g进行测定,加入足量稀硫酸充分反应后,配成250mL溶液。取该溶液25.00mL用bmol/L草酸溶液进行滴定,消耗草酸溶液cmL。则V2O5样品中钒的质量分数=_________%,样品的纯度≤___________%,样品的纯度小于该数值可能的原因是____________________________。(已知:①V2O5+2H+=2![]() +H2O ②2
+H2O ②2![]() +H2C2O4+2H+=2VO2+2CO2↑+2H2O)
+H2C2O4+2H+=2VO2+2CO2↑+2H2O)
【答案】升高酸浸温度和粉碎原料 使![]() 转化为VO2+ (VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O Fe(OH)3、Al(OH)3 蒸发结晶 3H2O+
转化为VO2+ (VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O Fe(OH)3、Al(OH)3 蒸发结晶 3H2O+![]() +6VO2+=6
+6VO2+=6![]() +Cl-+6H+ 0.4mol/L
+Cl-+6H+ 0.4mol/L ![]()
![]() 样品中含有NH4VO3
样品中含有NH4VO3
【解析】
从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂H2O2,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,萃取后水相1流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5。
(1) 酸浸”时V2O5转化为VO2+,为了提高“酸浸”效率可采取得措施为升高酸浸温度和粉碎原料。
(2)亚铁离子具有还原性,“酸浸”时加入FeSO4目的是使![]() 转化为VO2+,FeSO4参与反应的化学方程式为(VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O。
转化为VO2+,FeSO4参与反应的化学方程式为(VO2)2SO4+2FeSO4+2H2SO4=2VOSO4+Fe2(SO4)3+2H2O。
(3) 根据图示,加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,“滤渣2”的成分为Fe(OH)3、Al(OH)3;硫酸钾受热稳定,“操作1”的名称为蒸发结晶。
(4)在“氧化”步骤中氧化剂与还原剂的物质的质量之比为1:6,根据氧化还原反应原理,氧化剂为氯化钾,还原剂为VO2+,反应的离子方程式为3H2O+![]() +6VO2+=6
+6VO2+=6![]() +Cl-+6H+。
+Cl-+6H+。
(5)t℃时,“氧化”后溶液中c(![]() )=0.1mol/L,假设“沉钒”步骤中
)=0.1mol/L,假设“沉钒”步骤中![]() 全部转化
全部转化![]() ,化合价不变,c(
,化合价不变,c(![]() )=0.1mol/L,为使沉钒效率达到95%,则溶液中此时
)=0.1mol/L,为使沉钒效率达到95%,则溶液中此时![]() )≤0.005mol/L ,即c(
)≤0.005mol/L ,即c(![]() )≥
)≥![]() 0.4mol/L。
0.4mol/L。
(6)取“煅烧”后的V2O5样品m g进行测定,加入足量稀硫酸充分反应后,V2O5+2H+=2![]() +H2O,配成250mL溶液,取该溶液25.00mL用bmol/L草酸溶液进行滴定,消耗草酸溶液cmL,滴定过程中涉及的反应方程为2
+H2O,配成250mL溶液,取该溶液25.00mL用bmol/L草酸溶液进行滴定,消耗草酸溶液cmL,滴定过程中涉及的反应方程为2![]() +H2C2O4+2H+=2VO2+2CO2↑+2H2O,则滴定过程消耗的c(VO2+)=2bc×10-3mol,即五氧化二钒的物质的量为bc×10-3mol ,V2O5样品中钒的质量分数=
+H2C2O4+2H+=2VO2+2CO2↑+2H2O,则滴定过程消耗的c(VO2+)=2bc×10-3mol,即五氧化二钒的物质的量为bc×10-3mol ,V2O5样品中钒的质量分数=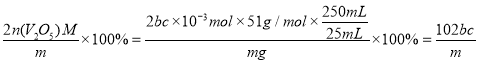 %,样品的纯度≤
%,样品的纯度≤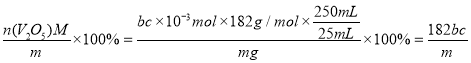 %,样品的纯度小于该数值可能的原因是样品中含有NH4VO3。
%,样品的纯度小于该数值可能的原因是样品中含有NH4VO3。


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
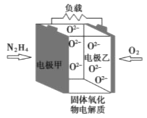
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式______________________________________________________。
(2)已知:C(s)+O2(g) = CO2(g) △H=-437.3kJ·mol -1
H2(g)+1/2O2(g) = H2O(g) △H=-285.8kJ·mol-1
CO(g)+1/2O2(g) = CO2(g) △H=-283.0kJ·mol-1
则煤气化反应C(s)+H2O(g) = CO(g)+H2(g)的焓变△H=___________ kJ·mol-1。
(3)人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
①铅蓄电池在放电时的电池反应为Pb+PbO2+2H2SO4==2PbSO4+2H2O,则其正极上的电极反应为________________________________________________________。
②FeCl3溶液腐蚀印刷电路铜板时发生反应:2FeCl3+Cu==2FeCl2+ CuCl2。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:_________________。
③已知甲醇燃料电池的工作原理如下图所示。该电池工作时,b口通入的物质为_____,该电池正极上的电极反应式为___________________;当6.4g甲醇(CH3OH)完全反应生成CO2时,有___ mol电子发生转移。若将电池的电解质溶液换为KOH溶液,则负极的电极方程式为______________________。
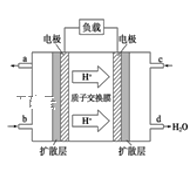
(4)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图表示的一些物质或概念间的从属关系中正确的是
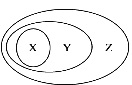
X | Y | Z | |
A | 水 | 单质 | 纯净物 |
B | 非金属氧化物 | 酸性氧化物 | 氧化物 |
C | 电解质 | 化合物 | 纯净物 |
D | 化合反应 | 氧化还原反应 | 化学反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无公害肥料 黑肥的主要成分是氰氨基化钙(CaCN2),CaCN2的制备原理为CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列叙述错误的是
A.H2为还原产物
B.![]() 、HCN中碳原子的杂化方式相同
、HCN中碳原子的杂化方式相同
C.CaCN2和CO2中所含化学键的类型不同
D.碳酸钙的分解温度比碳酸镁高的原因是Ca2+结合![]() 中O2-的能力比Mg2+弱
中O2-的能力比Mg2+弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O在涂料、有色玻璃和催化剂等领域有着广泛的用途。Cu2O为红色粉末,不溶于水,易溶于盐酸和稀硫酸。可用电解法制备氧化亚铜:用铜作阳极,钛片作阴极,电解液为一定浓度的NaCl和NaOH的混合溶液;阳极及其溶液中有关转化如图所示。下列说法错误的是

A.电解液中的NaOH不能用盐酸代替
B.过程①中Cu被氧化生成CuCl-
C.过程④的离子方程式为2Cu(OH)Cl-=Cu2O+2Cl-+H2O
D.当电路中有0.05mol e-通过时,消耗0.32g Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com