
下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C.铜、石墨均导电,所以它们都是电解质
D.蔗糖在水溶液中或熔融时均不导电,所以是非电解质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将5.4g Al投入200.0mL 2.0mol•L﹣1的某溶液中有氢气产生,充分反应后有金属剩余.该溶液可能为( )
|
| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对溴甲苯是重要的化工原料。工业用液溴、甲苯与1-丙醇共热联合制备对溴甲苯和1-溴丙烷,符合绿色化学的要求。实验室模拟的合成流程和相关数据如下:
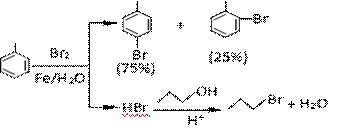
已知:甲苯与溴在有水存在时能反应。
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | |
| 沸点℃ | 110.8 | 97.2 | 71 | |
| 物质 | 对溴甲苯 | 邻溴甲苯 | ||
| 沸点℃ | 184.3 | 181.7 | ||

(1)实验室液溴存放试剂瓶里时应密闭保存,同时需要在瓶中加_____,以减少挥发。
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应,搅拌的目的是__________;加入水的作用是: ___________________。
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是______。
(4)操作Ⅰ的名称是___________,操作Ⅱ的名称 ;洗涤操作应在_________(填写仪器名称)中进行。
(5)分离出的水溶液中含HBr、H2SO4和Fe3+离子,同学甲为测定溶液的氢离子浓度将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,但是同学乙认为无需加入指示剂,也能完成滴定,同学乙提出这一观点的理由是_________。同学丙欲利用氧化还原的原理滴定Fe3+浓度,另取20.00mL,用0.1000mol/L的标准的碘化钾溶液滴定,可以用 做指示剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室内有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
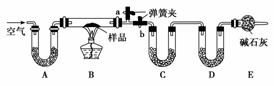
(1)实验时,B中发生反应的化学方程式为___________________________________
________________________________________________________________________。
(2)装置C、D中盛放的试剂分别为C________________,D________________(供选试剂为浓硫酸、无水CaCl2、碱石灰)。
(3)E装置中的仪器名称是________,它在该实验中的主要作用是__________________________。
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将________(填“偏高”、“偏低”或“无影响”)。
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是
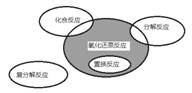 A.Cl2+2KBr===Br2+2KCl
A.Cl2+2KBr===Br2+2KCl
B.2NaHCO3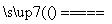 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化性:Br2>Fe3+>I2;还原性:I->Fe2+>Br-,则下列反应能发生的是( )
A.I2+2Fe2+===2Fe3++2I- B.2Br-+I2===Br2+2I-
C.2Fe3++2I-===2Fe2++I2 D.2Fe3++2Br-===2Fe2++Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)  4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
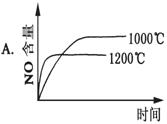
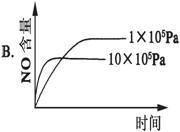
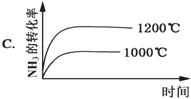
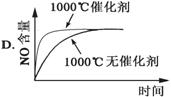
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备
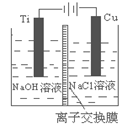 纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应
式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
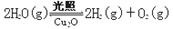 ⊿H >0
⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com