
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(17分)⑴ 溶解(2分)、过滤(2分) ⑵①2Fe2++H2O2 +2H+=2Fe3++2H2O(3分) ②3.7-6.0(2分)
⑶ 冷却结晶(2分) 防止CuSO4·5H2O晶体分解(2分)
⑷ 错误 (1分) 根据控制变量的思想,所用溶液的阴离子不同,无法比较阳离子的催化效率(2分)
(5)酸性 大于 形成原电池 2.2×10-8
解析试题分析:(1)步骤Ⅰ的目的是除不溶性杂质,所以所需操作的名称是溶解和过滤。
(2)①双氧水具有氧化性,能把亚铁离子氧化生成铁离子,则H2O2溶液除去硫酸亚铁的离子方程式是2Fe2++H2O2 +2H+=2Fe3++2H2O。
②氢氧化铜开始沉淀的pH是6。0,氢氧化铁完全沉淀的pH是3.7,所以调整pH 的范围应该在3.7~6.0之间。
(3)溶液加热蒸发至有晶膜出现时,停止加热,然后冷却结晶即可。水浴加热便于控制温度,可以防止CuSO4·5H2O晶体分解。
(4)根据控制变量的思想,所用溶液的阴离子不同,无法比较阳离子的催化效率,所以结论是错误的。
(5)硫酸铜溶于水,铜离子水解,溶液显酸性。由于1个铜离子水解生成2个氢离子,所以溶液中阳离子总数是增加的。铁能和硫酸铜发生置换反应,生成铜,从而构成原电池,加快反应速率。溶液的pH=8,则溶液中OH-的浓度是10-6mol/L,则根据氢氧化铜的溶度积常数可知,溶液中c(Cu2+)=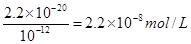 。
。
考点:考查化学基本实验操作、离子方程式的书写、离子的沉淀、外界条件对反应速率的影响以及溶度积常数的计算和应用
点评:该题是高考中的常见题型,难度大,对学生的要求高。有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。


科目:高中化学 来源: 题型:阅读理解
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| Ⅰ |
| Ⅱ |
| Ⅲ |

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)制备氧化铜
![]() CuSO4·5H2O……CuO
CuSO4·5H2O……CuO
①步骤Ⅰ的目的是除不溶性杂质。操作是___________________________________________。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热:Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是_________。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是__________________。水浴加热烘干。水浴加热的特点是___________________________________________________________。
(2)探究氧化铜性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是____________________________________________。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com