
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下都不能导电的化合物;例:有机物,非金属氧化物等;
强电解质:在水溶液中能完全电离的电解质;
弱电解质:在水溶液中部分电离的电解质;
单质与混合物既不是电解质也不是非电解质.
解答 解:a.氨水是混合物,既不是电解质也不是非电解质;
b.蔗糖 在水溶液中和熔融状态下都不能导电的化合物,是非电解质;
c.烧碱在水溶液中或熔融状态下能完全电离而产生自由移动离子而导电的化合物,是电解质,且是强电解质;
d.NH3•H2O 在水溶液中部分电离而导电,属于电解质,且是弱电解质;
e.CO2本身不能电离产生自由移动的离子的化合物,属于非电解质;
f.碳酸钙熔融状态下能够完全电离而导电的化合物,属于电解质,且是强电解质;
g.CH3COOH在水溶液中部分电离而导电,属于电解质,且是弱电解质;
h.铜是单质,既不是电解质也不是非电解质;
i.氯气 既不是电解质也不是非电解质;
j.石墨既不是电解质也不是非电解质;
k.稀盐酸,既不是电解质也不是非电解质;
l.HCl气体在水溶液中能够完全电离而导电的化合物,属于电解质,且是强电解质;
m.大理石熔融状态下能够完全电离而导电的化合物,属于电解质,且是强电解质;
n.熔融的氯化钠能够完全电离而导电的化合物,属于电解质,且是强电解质;
所以:其中属于电解质的是cdfgln;属于强电解质的是cfln;属于非电解质的是be;
故答案为:cdfgln; cfln; be.
点评 本题考查了电解质、非电解质、强电解质、弱电解质的判断,明确相关概念是解题关键,注意单质与混合物既不是电解质也不是非电解质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.4 mol/L | C. | 0.8mol/L | D. | 0.7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 | |
| D. | 往燃煤中混入生石灰,可减少SO2排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸的反应 Cu(OH)2+2H+=Cu2++2 H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于盐酸中 CaCO3+H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
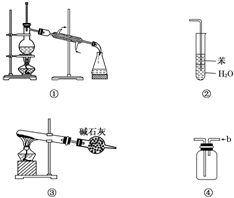
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收氨气,能够防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于制备少量CO2 | |
| D. | 装置④a口进气可收集Cl2、NO2等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com