
【题目】磷灰石是一系列磷酸盐矿物的总称,主要指氟磷灰石[Ca5(PO4)3F],以氟磷灰石为原料可制备缓冲试剂磷酸二氢钾(KH2PO4),其工艺流程如图所示:
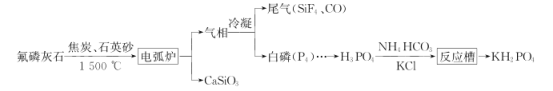
回答下列问题:
(1)电弧炉中发生反应的化学方程式:__。
(2)制得的白磷中常含有少量的砷,利用稀硝酸,可将砷转化为亚砷酸(H3AsO3)和砷酸(H3AsO4)而除去。使用质量分数为25%(密度为1.15g·cm-3)的硝酸效果最佳,此硝酸的质量摩尔浓度(单位质量的溶剂中所含溶质的物质的量)为__×10-3mol·g-1(保留一位小数),除砷过程中需要控制温度为75℃,且在高纯N2的保护下进行,温度不能过高的原因是__。
(3)反应槽中发生反应的离子方程式为__。
(4)通过如图电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾。膜1为__(填“阳离子”或“阴离子”)交换膜,阳极电极反应式为__,转移0.15mol电子,理论上获得磷酸的质量为__g。
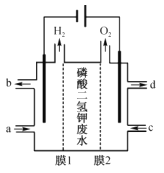
(5)自然界中Ca5(PO4)3OH与Ca5(PO4)3F存在如下平衡:Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
【答案】![]() 5.3 温度过高,硝酸会大量分解
5.3 温度过高,硝酸会大量分解 ![]() 1 阳离子
1 阳离子 ![]() 14.7 2.5×1024
14.7 2.5×1024
【解析】
(1)由流程图可知,电弧炉中发生的反应为Ca5(PO4)3F与焦炭、石英砂(主要成分为SiO2)在1500。C高温下反应生成CaSiO3、白磷、SiF4和CO,根据元素守恒、得失电子守恒配平该化学方程式;
(2)根据质量摩尔浓度的定义,取质量分数为25%的硝酸100g,则溶质硝酸的质量为25g,溶剂水的质量为75g,进行计算;硝酸不稳定,受热易分解;
(3)由流程图可知,反应槽中磷酸与碳酸氢根反应生成磷酸二氢根、水和二氧化碳;
(4)根据图示电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾,写出电极反应式,判断离子交换膜,根据反应的比例关系确定磷酸的质量;
(5)先列出该反应的平衡常数的表达式,进而转化为溶度积之比。
(1)由流程图可知,电弧炉中发生的反应为Ca5(PO4)3F与焦炭、石英砂(主要成分为SiO2)在1500。C高温下反应生成CaSiO3、白磷、SiF4和CO,根据元素守恒、得失电子守恒配平该化学方程式,故答案为:![]() ;
;
(2)取质量分数为25%的硝酸100g,则溶质硝酸的质量为25g,溶剂水的质量为75g,则硝酸的质量摩尔浓度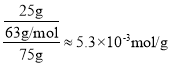 ,硝酸不稳定,温度过高,硝酸会大量分解,因此需要控制温度为75℃,故答案为:5.3;温度过高,硝酸会大量分解;
,硝酸不稳定,温度过高,硝酸会大量分解,因此需要控制温度为75℃,故答案为:5.3;温度过高,硝酸会大量分解;
(3)由流程图可知,反应槽中磷酸与碳酸氢根反应生成磷酸二氢根、水和二氧化碳,符合强酸制弱酸,从而得到KH2PO4,发生反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)已知通过图示电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾,阳极发生反应![]() ,膜2为阴离子交换膜,中间隔室的磷酸二氢根离子移动向阳极,与氢离子结合生成磷酸
,膜2为阴离子交换膜,中间隔室的磷酸二氢根离子移动向阳极,与氢离子结合生成磷酸![]() ,阴极发生反应2H2O+2e- = H2↑+2OH-,膜1为阳离子交换膜,中间隔室的钾离子移动向阴极,在阴极得到氢氧化钾,转移0.15mol电子,阳极生成0.15mo氢离子,会有0.15molH2PO4-移动向阳极生成0.15mol H3PO4,则理论上获得磷酸的质量为0.15mol×98g/mol=14.7g,故答案为:阳离子;
,阴极发生反应2H2O+2e- = H2↑+2OH-,膜1为阳离子交换膜,中间隔室的钾离子移动向阴极,在阴极得到氢氧化钾,转移0.15mol电子,阳极生成0.15mo氢离子,会有0.15molH2PO4-移动向阳极生成0.15mol H3PO4,则理论上获得磷酸的质量为0.15mol×98g/mol=14.7g,故答案为:阳离子;![]() ;14.7;
;14.7;
(5)该反应的平衡常数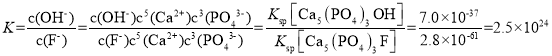 ,故答案为:2.5×1024。
,故答案为:2.5×1024。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用图所示装置进行实验。
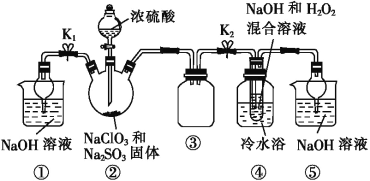
(1)装置①的作用是___________________,装置③的作用是________________。
(2)装置②中制备ClO2的化学方程式为___________________________;装置④中反应生成NaClO2的化学方程式为_____________________。
(3)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是取少量晶体溶于蒸馏水,__________________________________________________________。
(5)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,重复2次,平均消耗Na2S2O3溶液20.00 mL,计算得NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵态氮肥和草木灰混合会降低肥效的原因是____________________,CH3COO-- 和NH4+、CO32--和NH4+在溶液中都是相互__________(促进或者抑制)的双水解,但是水解程度不大,可以大量共存。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是
SnI4制备SnI4。下列说法错误的是
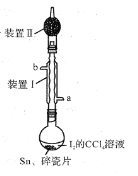
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
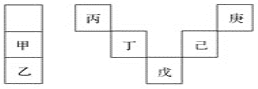
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是稀硫酸与某金属反应的实验数据:
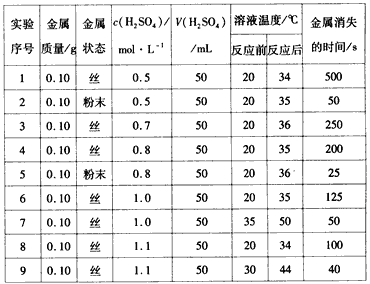
分析上述数据,完成下列问题:
(1)实验4和5表明____________对反应速率有影响,________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:____
查看答案和解析>>
科目:高中化学 来源: 题型:
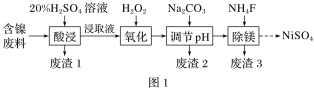
【题目】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
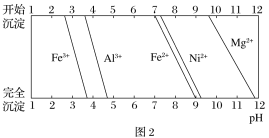
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
②25 ℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,Ksp(MgF2)=7.4×10-11。
(1)“酸浸”时,为提高浸出速率,可采取的措施有______________(写一条即可)。
(2)废渣1的主要成分是________(填化学式)。“氧化”步骤中加入H2O2的目的是____________(用离子方程式表示)。加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是____________(填化学式)。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=____________(列出计算式即可) mol·L-1。NH4F溶液呈________(填“酸性”“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:
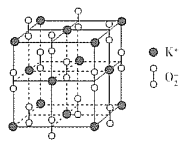
则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语,应用正确的是 ( )
A.硝基苯的结构简式是:![]()
B.乙炔的电子式是:![]()
C.乙醚分子的球棍模型是: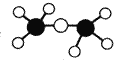
D.甲酸中存在一CHO和—COOH两种官能团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com