
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:
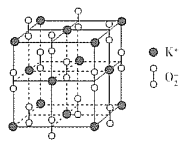
则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
【答案】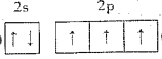 由高能量状态跃迁到低能量状态 N>O>S>K O sp2 直线型 草酸分子间能形成更多氢键 2:1 12
由高能量状态跃迁到低能量状态 N>O>S>K O sp2 直线型 草酸分子间能形成更多氢键 2:1 12 ![]()
【解析】
根据核外电子排布特点及非金属性强弱比较第一电离能大小;根据等电子体结构及杂化轨道理论分析分子的空间结构;根据晶胞的结构计算晶胞的密度。
(1)N原子价电子数为5,其电子排布图为 ;焰色反应属于发射光谱,故电子是由高能量状态跃迁到低能量状态,由第一电离能递变规律及N原子的2p能级处于半充满状态得第一电离能的大小顺序为N>O>S>K;上述反应涉及的元素中氧元素的非金属性最强,故电负性最大,
;焰色反应属于发射光谱,故电子是由高能量状态跃迁到低能量状态,由第一电离能递变规律及N原子的2p能级处于半充满状态得第一电离能的大小顺序为N>O>S>K;上述反应涉及的元素中氧元素的非金属性最强,故电负性最大,
故答案为:; ;由高能量状态跃迁到低能量状态;N>O>S>K;O;
;由高能量状态跃迁到低能量状态;N>O>S>K;O;
(2)①C2O3中碳原子形成3个σ键、为sp2杂化;CO2中C原子采取sp杂化,立体构型为直线型;
②草酸分子中有2个O-H键,丁酸分子中只含有一个O-H键,故草酸分子间形成的氢键数目比丁酸分子间形成的氢键数目多,因此其沸点比较高;
③CO与N2互为等电子体,结构相似,故π键与σ键个数比为2:1;
故答案为:sp2;直线型;草酸分子间能形成更多氢键;2:1;
(3)由晶胞图知,同一平面内与K+距离相等且最近的K+有4个,通过某一个K+且相互垂直的平面有3个,故共有12个K+符合条件;由均摊原理知每个晶胞中含有4个KO2,质量为4/NA×71g,晶胞的体积为d3×10-30cm3,故密度为:![]() g/cm3,
g/cm3,
故答案为:12;![]() 。
。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】纳米磷化钴(CoP)常用于制作特种钻玻璃,制备磷化钴的常用流程如下:
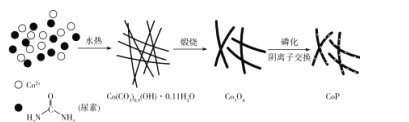
(l)基态P原子的价电子排布式为____,P位于元素周期表中____区。
(2)尿素中N原子的杂化类型是 _____;C、N、O三种元素的第一电离能最大的是____,电负性由小到大的顺序为____。
(3)Co(CO3)0.5(OH)·0.11H2O中CO32-中C的价层电子对数为____;该化合物中不含有的化学键有_____填标号)。
A 离子键 B 共价键 C 金属键 D 配位键 E 氢键 F 非极性键
(4)一些氧化物的熔点如下表所示:
![]()
解释表中氧化物之间熔点差异的原因____。
(5)CoP的晶胞结构如图所示,最近且相邻两个钴原子的距离为npm。
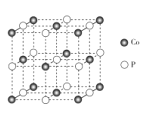
设NA为阿伏加德罗常数的值,则其晶胞密度为_______-g.cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷灰石是一系列磷酸盐矿物的总称,主要指氟磷灰石[Ca5(PO4)3F],以氟磷灰石为原料可制备缓冲试剂磷酸二氢钾(KH2PO4),其工艺流程如图所示:
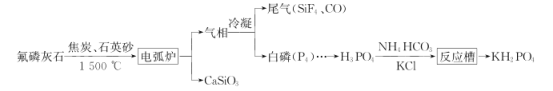
回答下列问题:
(1)电弧炉中发生反应的化学方程式:__。
(2)制得的白磷中常含有少量的砷,利用稀硝酸,可将砷转化为亚砷酸(H3AsO3)和砷酸(H3AsO4)而除去。使用质量分数为25%(密度为1.15g·cm-3)的硝酸效果最佳,此硝酸的质量摩尔浓度(单位质量的溶剂中所含溶质的物质的量)为__×10-3mol·g-1(保留一位小数),除砷过程中需要控制温度为75℃,且在高纯N2的保护下进行,温度不能过高的原因是__。
(3)反应槽中发生反应的离子方程式为__。
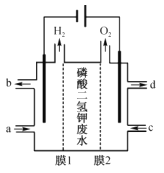
(4)通过如图电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾。膜1为__(填“阳离子”或“阴离子”)交换膜,阳极电极反应式为__,转移0.15mol电子,理论上获得磷酸的质量为__g。
(5)自然界中Ca5(PO4)3OH与Ca5(PO4)3F存在如下平衡:Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
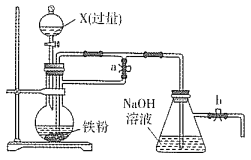
A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物F(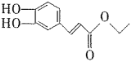 )在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
)在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
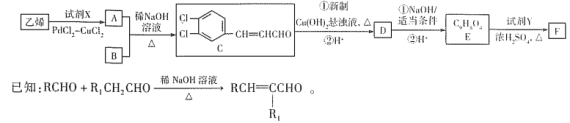
(1)乙烯生成A的原子利用率为100%,则X是___________(填化学式),F中含氧官能团的名称为___________。
(2)E→F的反应类型为___________,B的结构简式为___________,若E的名称为咖啡酸,则F的名称是___________。
(3)写出D与NaOH溶液反应的化学方程式:_________________________________。
(4)E有多种同分异构体,符合下列条件的同分异构体有___________种,其中核磁共振氢谱有6个峰的物质的结构简式为___________。
①能发生水解反应、银镜反应且1mol该物质最多可还原出4 mol Ag
②遇FeCl3溶液发生显色反应
③分子中没有甲基,且苯环上有2个取代基
(5)以乙烯为基本原料,设计合成路线合成2-丁烯酸,写出合成路线:______________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+nH2O![]() nC6H12O6 ②C6H12O6
nC6H12O6 ②C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示_____ ____(填物质名称);
(2)C6H12O6名称是_________,常用_____ ____试剂来检验其存在;
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈_________色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成____ ____(填实验现象);
(4)下列作用不属于水解反应的是_________
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,如图为CO2的水溶液中加入强酸或强碱溶液后,平衡时溶液中各种组分的pC - pH图。依据图中信息,下列说法不正确的是
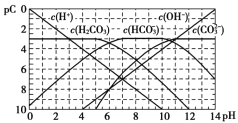
A.![]() 不能在同一溶液中大量共存
不能在同一溶液中大量共存
B.H2CO3电离平衡常数![]()
C.人体血液里主要通过碳酸氢盐缓冲体系(![]() )可以抵消少量酸或碱,维持pH =7.4,但当过量的酸进入血液中时,血液缓冲体系中的
)可以抵消少量酸或碱,维持pH =7.4,但当过量的酸进入血液中时,血液缓冲体系中的![]() 最终将变大
最终将变大
D.pH =9时,溶液中存在关系![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 K 是某药物的中间体,合成路线如图所示:
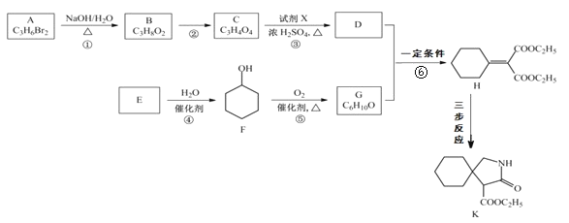
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com