
【题目】下列关于各实验装置图的叙述中正确的是
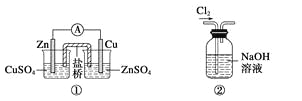
A.装置①:构成锌—铜原电池
B.装置②:除去Cl2中含有的少量HCl
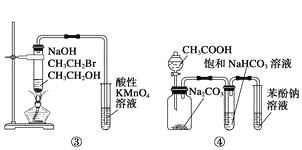
C.装置③:验证溴乙烷发生消去反应生成烯烃
D.装置④:由实验现象推知酸性强弱顺序为:CH3COOH>H2CO3>C6H5OH
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中不正确的是

A.图①表示CO(g)+H2O(g)![]() CO2(g)+H2(g)是放热反应
CO2(g)+H2(g)是放热反应
B.图②为电解硫酸铜溶液的装置,电解一段时间后,加入一定量的Cu(OH)2一定不能使溶液恢复到电解前的浓度和体积
C.图③实验装置可一次而又科学准确的完成比较HCl、H2CO3、H2SiO3酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,正极生成气体的物质的量也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)

常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是_____________________________(至少一条)
(2)调pH=4.0是为了除去______________________(填Fe3+, Al3+, Ca2+, Mg2+)
(3)钠离子交换树脂的原理为Mn++ n NaR → MRn+nNa+,被交换的杂质离子是___________________________(填Fe3+, Al3+, Ca2+, Mg2+)
(4)试配平下列氧化还原反应方程式:
____Na2Cr2O7+__SO2+____H2O =____Cr(OH)(H2O)5SO4+___Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中存在许多平衡,如化学平衡、电离平衡、水解平衡、溶解平衡等等,对应的有化学平衡常数、电离平衡常数等。按要求回答下列问题:
(1)反应H2(g)+I2(g)2HI(g)的平衡常数为K1;反应HI(g)![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
(2)汽车净化原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。

(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-H++B2-。在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是___。
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(4)下表为几种酸的电离平衡常数
CH3COOH | H2CO3 | H2S |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为___,少量CO2与NaHS反应的离子方程式为___。
(5)25℃时,向0.01molL-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为___;当Mg2+完全沉淀时,溶液的pH为___(忽略溶液体积变化,已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,已知lg2.4=0.4,lg7.7=0.9。
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应:Fe(OH)3+3H+Fe3++3H2O的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )
A.装置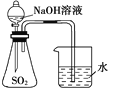 可用于证明
可用于证明![]() 与NaOH溶液发生了反应
与NaOH溶液发生了反应
B.装置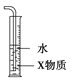 中X为
中X为![]() ,可用于吸收氨或氯化氢
,可用于吸收氨或氯化氢
C.装置 可用于实验室从食盐水中提取氯化钠
可用于实验室从食盐水中提取氯化钠
D.装置 可用于证明浓硫酸与乙醇共热生成乙烯
可用于证明浓硫酸与乙醇共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 往1mL 0.1mol/L AgNO3溶液中滴入2滴0.1 mol/L 的NaCl溶液,再往混合溶液中滴入2滴0.1 mol/L KI溶液,充分振荡 | 先产生白色沉淀,后出现黄色沉淀 | Ksp(AgCl) >Ksp (AgI) |
B | 一定条件下,密闭容器反应达平衡: H2(g)+I2(g) | 气体颜色加深 | 平衡逆移 |
C | 等体积、等pH的HA和HB两种酸溶液分别与足量的大小相同的锌反应 | 反应开始后HA产生H2的速率更快 | HA是弱酸 |
D | 向锌粒与稀硫酸反应的试管中滴加几滴CuSO4溶液 | 产生气体的速率明显加快 | CuSO4对该反应有催化作用 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJmol-1,则水电解的热化学方程式为:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol甲烷完全燃烧生成CO2 (g)和H2O(l)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.已知2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )

A.温度T℃下,该反应的平衡常数K=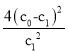
B.温度T℃下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b改变的条件是温度,则该反应△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com