
| A.①③④ | B.①② | C.① | D.①②⑤⑥ |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:填空题
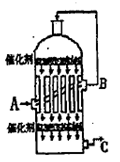
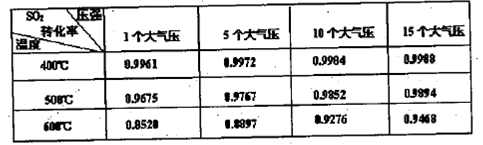
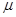 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.海水pH约为8的原因主要是天然海水含CO32-、HCO3- |
B.吸收塔中发生的反应有SO2+H2O H2SO3 H2SO3 |
| C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42- |
| D.经稀释“排放”出的废水中,SO42-浓度与海水相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
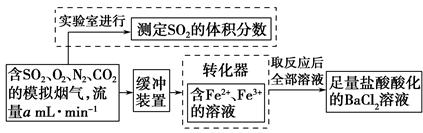
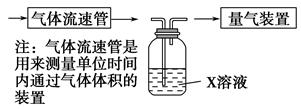
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
 的转化率,已知气体流速,还需测定的数据有 、 。
的转化率,已知气体流速,还需测定的数据有 、 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯气除杂过程中通入浓硫酸中 |
| B.浓硫酸与木炭共热 |
| C.乙酸乙酯与稀硫酸共热 |
| D.浓硫酸滴到蔗糖中制“黑面包” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有0.09 mol的硫酸被还原 |
| B.有0.045 mol的硫酸被还原 |
| C.充分反应后体系无硫酸剩余 |
| D.消耗的铜的质量一定小于2.88 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.当X是盐酸时,则F是稀硝酸 |
| B.当X是氢氧化钠时,则F是稀硝酸 |
| C.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象 |
| D.当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.新制的氯水 | B.品红溶液 | C.滴有酚酞的NaOH稀溶液 | D.H2S气体 |
| 性质 | 试剂 | 化学方程式 |
| 漂白性 | | |
| 氧化性 | | |
| 还原性 | | |
| 酸性氧化物 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com