
 CO2(g)+H2(g)
CO2(g)+H2(g)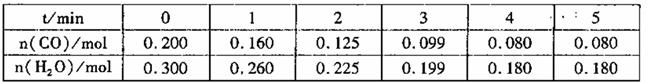
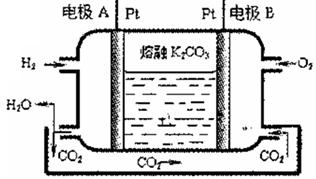
 (2分)
(2分) 。
。 =1。
=1。 =4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。
=4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题

| A.铍的金属性比钠强 |
| B.氯化铍的氧化性比氯化锂弱 |
| C.氢氧化铍的碱性比氢氧化钙弱 |
| D.单质铍易跟冷水反应生成H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P l00 kPa | 4 | 4.6 | 5.4 | 5.8 | 6 | 6 |
 H=+67.7 kJ·mol-1。
H=+67.7 kJ·mol-1。 H="-534" kJ·mol-1。
H="-534" kJ·mol-1。 H= kJ·mol-1
H= kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。| A.XY2和WZ2都为离子化合物 |
| B.XY2分子中仅含离子键,WZ2中仅含极性共价键 |
| C.H2Z比HY的稳定性强 |
| D.X的阳离子比Y的阴离子半径大 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
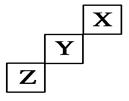
| A.X、Y、Z三种元素中,X的非金属性最强 |
| B.Y氢化物的稳定性比Z的氢化物弱 |
| C.Y的最高正化合价为+7价 |
| D.X单质的熔点比Z的低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
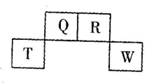
| A.气态氢化物稳定性:R>Q |
B.元素T的离子结构示意图为 |
| C.与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 |
| D.Q可形成多种含氧酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. | B. |
C.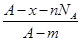 | D. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com