
【题目】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____(填元素符号),写出Fe2+的最外层电子排布式____。
(2)根据等电子原理,写出CN-的电子式___,CNO-中心原子的杂化方式为 ________。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是 ___(用化学式表示),![]() 的沸点比
的沸点比 ____(填“高”或“低”);原因是______________________.
____(填“高”或“低”);原因是______________________.
(4)铁有δ、γ、α三种同素异形体,如下图所示。

γ -Fe晶体的一个晶胞中所含有的铁原子数为____,δ一Fe、α- Fe两种晶胞中铁原子的配位数之比为____。已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____pm(列表达式)。
【答案】 O 3s23p63d6 ![]() sp MgO〉CaO 高 由于
sp MgO〉CaO 高 由于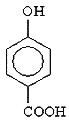 可形成分子间氢键,而
可形成分子间氢键,而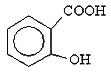 可形成分子内氢键,故
可形成分子内氢键,故 的沸点比
的沸点比 高 4 4:3
高 4 4:3 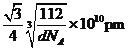
【解析】(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,所以电负性最大的是O;基态Fe原子的核外价电子排布式为[Ar]3d64S2,则Fe2+的最外层电子排布式为3s23p63d6,故答案为:O;3s23p63d6;
(2) CN-与N2属于等电子体,则CN-的电子式为![]() ,CNO-与CO2属于等电子体,二氧化碳为直线分子,中心原子的杂化方式为sp杂化,故答案为:
,CNO-与CO2属于等电子体,二氧化碳为直线分子,中心原子的杂化方式为sp杂化,故答案为:![]() ;sp;
;sp;
(3) 离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,镁离子半径小于钙离子半径,则熔点MgO>CaO;由于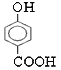 可形成分子间氢键,而
可形成分子间氢键,而![]() 可形成分子内氢键,故
可形成分子内氢键,故 的沸点比
的沸点比![]() 高,故答案为:>;高;由于
高,故答案为:>;高;由于 可形成分子间氢键,而
可形成分子间氢键,而![]() 可形成分子内氢键,故
可形成分子内氢键,故 的沸点比
的沸点比![]() 高;
高;
(4) γ晶体晶胞中所含有的铁原子数为8×![]() +6×
+6×![]() =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,由晶胞图可知,δ型晶体铁晶胞中Fe原子数目为8×
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,由晶胞图可知,δ型晶体铁晶胞中Fe原子数目为8×![]() +1=2,晶胞质量为
+1=2,晶胞质量为![]() g,δ型晶体铁的密度为dg/cm3,晶胞体积为
g,δ型晶体铁的密度为dg/cm3,晶胞体积为![]() g÷dg/cm3=
g÷dg/cm3=![]() cm3,则晶胞棱长=
cm3,则晶胞棱长=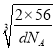 cm,处于体对角线上的原子相邻,则4r=
cm,处于体对角线上的原子相邻,则4r=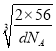 cm×
cm×![]() ,故r=
,故r=![]() ×
×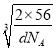 cm=
cm=![]() ×
×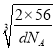 ×1010pm,故答案为:4;4:3;
×1010pm,故答案为:4;4:3; ![]() ×
×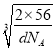 ×1010。
×1010。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.离子化合物只能由金属元素和非金属元素组成
B.离子化合物只能存在离子键
C.盐酸能电离出氢离子和氯离子,所以HCl存在离子键
D.共价化合物中不可能存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关。下列说法不正确的是
A.低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放
B.用稀双氧水清洗伤口可以杀菌消毒
C.“绿色化学”的核心是使原料尽可能全部转化为目标产物
D.高纯度的硅单质广泛用于制作光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. 二氧化硫具有氧化性,可用于漂白纸浆
B. 葡萄糖具有还原性,可用于化学镀银
C. 氢氧化铝受热易分解,可用作胃酸中和剂
D. 生石灰能与水反应,可用来干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是利用钛铁矿(主要成分FeTiO3)制金属钛的副产品,价格低。以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:

已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请问答下列问题:
(1)写出反应①生成铁黄(FeOOH)的离子方程式:__________________________________,
在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)“过滤、洗涤、干燥”制备铁黄时,检验铁黄表面已洗涤干净的操作是_____。
(3)写出反应③的化学方程式: ____。
(4)在溶液I中加KOH固体的目的是_____。
(5) K2FeO4可作为新型多功能水处理剂的原因是____。
(6)该工艺每消耗标准状况下ll2LCl2理论上得到____g K2FeO4。
(7)钛铁矿加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后铁的化合价不变,化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法:Ⅰ、原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________________。
a、碳酸氢钠难溶于水 b、碳酸氢钠受热易分解
c、碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

回答下列有关问题:
①乙装置中的试剂是________________;
②丁装置中稀硫酸的作用是________________;
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从_________管通入_________气体,再从________管中通入________气体。
②有同学建议在戊装置的b导管下端连接己装置,理由是________________________。
(3)请再写出一种实验室制取少量碳酸氢钠的方法_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
A.1:3 B.2:5 C.1:4 D.2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01 mol·L-1NaHY(酸式盐,Y表示原子或原子团)溶液,下列说法正确的是
A. 溶液一定呈酸性
B. 溶液中一定存在:Y2-+H2O![]() OH-+HY-
OH-+HY-
C. 溶液加水稀释,离子浓度都减小
D. 溶液中:c(Na+)≥c(Y2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com