
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:

(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
【答案】 酒精灯 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
【解析】(1)利用铜和浓硫酸制取SO2,选择固体与液体反应且需加热装置,故发生装置还需选用的仪器是酒精灯;Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;
④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,该反应为:SO2+Cl2+2H2O═2HCl+H2SO4,实验现象为氯水褪色,二氧化硫中S元素的化合价升高被氧化,说明二氧化硫具有还原性,故答案为:
装置 | 实验现象 | 体现SO2的性质 |
① | 溶液变红色 | 二氧化硫水溶液显酸性 |
② | 溶液褪色 | 漂白性 |
③ | 溶液变浑浊 | 氧化性 |
④ | 氯水褪色 | 还原性 |
点睛:本题考查物质制备实验及性质实验,主要考查了二氧化硫的化学性质及检验方法,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法。综合性较强的为(4)①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,据此进行解答。
【题型】实验题
【结束】
28
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
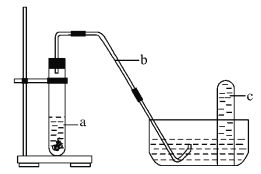
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。
【答案】 100mL容量瓶 10.0 AC Cu(NO3)2 装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
【解析】(1)实验室没有95mL规格的容量瓶,必须配制100mL,配制100mL1.0molL-1的硝酸溶液步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器有:烧杯、玻璃棒、100ml容量瓶、胶头滴管,所以需要的玻璃仪器是:100mL容量瓶;(2)配制100mL1.0molL-1的硝酸溶液,设需要10molL-1的浓硝酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:100mL×1.0molL-1=10molL-1×V,解得V=10mL;(3)A.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,选项A选;B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏低,选项B不选;
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,选项C选;D.容量瓶用蒸馏水洗涤后未烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,选项D不选;E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯,则相当于所量硝酸偏多,导致所配溶液浓度偏大,选项E不选。答案选AC;(4)①铜与硝酸反应生成硝酸铜,化学式为Cu(NO3)2;②装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2,即使开始没有NO2而只有NO气体也可能变成红棕色,反应初期试管上方有浅红棕色气体出现;
③二氧化氮能够与水反应生成硝酸和一氧化氮,反应方程式:3NO2+H2O = 2HNO3+NO,所以红棕色气体在试管c中颜色消失。


科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,将充满NO2的试管倒扣到盛水的水槽中,一段时间后,试管内气体的体积是试管体积的________________,假设试管内溶质不扩散,则试管内溶液中溶质的物质的量浓度为___________________。
(2)某铁的“氧化物”样品,用5mol/L的盐酸100mL恰好完全溶解,所得溶液还能吸收标准状况下1.12L氯气,使其中Fe2+恰好全部转化为Fe3+,发生反应的离子方程式为_________,该样品中Fe和O的个数比为_______________。
(3)向盛有10mL1mol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:(已知NH4++OH-=NH3·H2O)
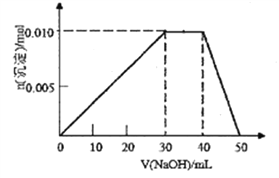
①写出滴加NaOH溶液40~50mL时反应的离子方程式:__________________。
②若10mL1mol/LNH4Al(SO4)2溶液中改加20mL1.15mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡. I、已知H2A在水中存在以下平衡:H2AH++HA﹣ , HA﹣H++A2﹣ .
(1)NaHA溶液的pH(填大于、小于或等于) Na2A溶液的pH.
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是 . a.c(H+)c(OH﹣)=1×10﹣14 b.c(Na+)+c(K+)=c(HA﹣)+2c(A2﹣)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0. ①降低温度时,Ksp(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)(填“增大”、“减小”或“不变”).
(4)II、含有Cr2O72﹣的废水毒性较大,某工厂废水中含5.00×10﹣3 molL﹣1的Cr2O72﹣ . 为使废水能达标排放,作如下处理: Cr2O72﹣ ![]() Cr3+、Fe3+
Cr3+、Fe3+ ![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和H+ , 发生反应的离子方程式为: .
②欲使10L该废水中的Cr2O72﹣完全转化为Cr3+ , 理论上需要加入g FeSO47H2O.
③若处理后的废水中残留的c(Fe3+)=2×10﹣13molL﹣1 , 则残留的Cr3+的浓度为 . (已知:Ksp[Fe(OH)3]=4.0×10﹣38 Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
(三) | (一) | (五) |
|
|
|
(二) | (六) | (四) |
|
|
|
(1)图中A、B、C三种仪器的名称分别是。
(2)将以上仪器按(一)~(六)顺序,用字母a,b,c…表示连接顺序:
e接;接;接;接;接。
(3)A仪器中c口是 , d口是(填“进水口”或“出水口”)。
(4)蒸馏时,温度计水银球应在位置。
(5)在B中注入原油后,加几片碎瓷片的目的是。
(6)给B加热,收集到沸点60~150℃间的馏分是 , 收集到150~300℃间的馏分是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒﹣﹣空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5 , 室温下用该电池为电源,用惰性电极电解饱和氛化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( ) 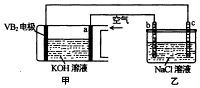
A.外电路中电子由a电极流向b电极
B.电极上生成气体的体积为4.48L
C.乙装置中溶液的pH为13
D.VB2电极发生的电极反应为:VB2+11H2O﹣22e﹣=VB2+2B2O3+22H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B.乙装置中铁电极为阴极,电极反应式为Fe﹣2e ﹣=Fe2+
C.通入氧气的一极为正极,发生的电极反应为O2﹣4e ﹣+2H2O═4OH﹣
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.乙烯能与溴的四氯化碳溶液反应使溶液逐渐褪色
B.乙醛能与新制氢氧化铜反应产生砖红色沉淀
C.糖类物质都能发生水解反应
D.在一定条件下,氨基酸之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法正确的是( )
A.乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气
B.乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气
C.乙炔中混有硫化氢,将其通入溴水中洗气
D.溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com