
下列解释事实的方程式不正确的是
A.向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++ 3NH3·H2O===Al(OH)3+ 3NH4+
B.加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3+ + 3OH—== Fe(OH)3↓
C.常温下0.1mol/L 氯化铵溶液pH=5:NH4+ +H2O  NH3·H2O+ H+
NH3·H2O+ H+
D.电解精炼铜时阳极铜溶解:Cu — 2e— === Cu2+
科目:高中化学 来源:2014-2015宁夏银川市高二下学期3月月考化学试卷(解析版) 题型:填空题
(8分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的电子排布式为_____________________;
(2)写出与CO互为等电子体的分子__________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
①TiCl4为______化合物(填“离子”或“共价”)(已知电负性:Ti—1.5,Cl—3.0);
②TiCl4分子为正四面体形,则Ti为________杂化;
③配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 ;
(4)TiCl4在潮湿空气中水解的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省丽水市高三第一次模拟理综化学试卷(解析版) 题型:填空题
(15分)汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g),请回答下列问题:
N2(g)+2CO2(g),请回答下列问题:
(1)对于气相反应,用某组分B平衡时的分压p(B)代替物质的量浓度c(B)也可表示平衡常数,记作KP,则该反应的平衡常数KP表达式为 ;
(2)已知:N2(g) + O2(g) =2NO(g) △H=+180.5kJ·mol-1
C(s) + O2(g) = CO2(g) △H=-393.5 kJ·mol-1
2C(s) + O2(g) =2CO(g) △H=-221kJ·mol-1
则2NO(g)+2CO(g) N2(g)+2CO2(g)的△H= ,该反应能自发进行的条件 (填“高温”、“低温”或“任意温度”);
N2(g)+2CO2(g)的△H= ,该反应能自发进行的条件 (填“高温”、“低温”或“任意温度”);
(3)在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol。
①若保持体积不变,再向容器中充入n(CO2)= b mol,n(NO)= a mol,则此时v正 v逆(填“>”、“=”或“<”);
②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在下图中补充画出t2-t3-t4时段N2物质的量的变化曲线。

(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。

①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右;
②目前对氮氧化物(NOx)进行治理的方法比较多,其中吸附/吸收法广受欢迎。下列物质适合作为NOx吸收剂的是
A.活性炭 B.氨水 C.酸性尿素溶液 D.硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古呼伦贝尔市高三高考模拟考(一)理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+)
B.醋酸与醋酸钠的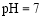 的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+)
的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+)
C.相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三一模理综化学试卷(解析版) 题型:填空题
(12分)海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

将Br2与Na2CO3反应的化学方程式补充完整:

(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于在恒温恒容容器中进行的反应A(g)+2B(g) 3C(g)+D(g),以下不能说明已达平衡状态的是
3C(g)+D(g),以下不能说明已达平衡状态的是
A.反应容器中,压强不随时间改变而改变
B.单位时间内生成3nmolC的同时生成nmolA
C.反应容器中,混合气体的平均相对分子质量不再改变
D.反应容器中的气体密度不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)画出D元素的原子结构示意图 。
C、D、E的简单离子半径由小到大的顺序 ( 用离子符号表示)。
(2)写出元素E在周期表中的位置 。
(3)工业上常用A和B的单质合成一种常见气体,检验该气体的常用方法是 。
(4)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(5)由元素A、B、C按原子个数比4:2:3形成的化合物,写出其电离方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关做法正确的是
A.将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌
B.实验室制取氯气时,尾气用碱液吸收
C.金属钠、镁着火时,可用泡沫灭火器来灭火
D.夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 |
|
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4,除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com