
| ���� |
| 3 |
| 2 |

| ���� | H2 | CO | CH3OH |
| Ũ�ȣ�mol?L-1�� | 0.2 | 0.1 | 0.4 |
| ��c |
| ��t |
| ���� |
| c(CO)��c(H2) |
| c(H2O) |
| c(CO)��c(H2) |
| c(H2O) |
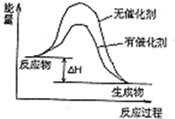 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��| 0.8mol/L |
| 10min |
| 0.4 |
| 0��22��0.1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=0����Һ�У�Ca2+��Al3+��ClO-��Cl- |
| B�����д���AlO2-����Һ�У�K+��Ca2+��Br-��HCO3- |
| C������Mg�ܷų�H2����Һ�У�Na+��NH4+��Cl-��SO42- |
| D����̪����ɫ����Һ�У�K+��Fe3+��NO3-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������ȣ�ClO2����һ�ָ�Ч�����ס���ȫ��ɱ������������
�������ȣ�ClO2����һ�ָ�Ч�����ס���ȫ��ɱ�������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ˮ��Ӧ��Cl2+H2O��2H++Cl-+ClO- |
| B������ͭ��Һ������������Һ��Ӧ��Ba2++SO42-��BaSO4�� |
| C������������Һ��ͨ��CO2��ClO-+CO2+H2O��HCO3-+HClO |
| D��̼����м�����CO32-+2CH3COOH��CO2��+2CH3COO-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��32g�����У�������ԭ��2NA |
| B���ڱ�״���£�2.24L��������������ԼΪNA |
| C��9g D2O�к��еĵ�����Ϊ5NA |
| D��7.1g��������������������Һ��Ӧת�Ƶĵ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ˮ������Cl2+H20�THCl+HCl0 | ||||
B���ô�����������β���е�C0��N0��CO+N0
| ||||
| C��NaOH��Һ���ܱ����ڲ��������Լ�ƿ�У�Si02+20H-�TSi032-+H2O | ||||
D�����ȵ���˿��нӴ��������γ�����ɫ�����ɫ�������㣺3Fe+4H20
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��һ�� | �ڶ��� | ������ | |
| ��Ʒ������/g | 12.60 | 18.90 | 28.00 |
| ������̼�����/L | 1.12 | 1.68 | 2.24 |
| �������/g | 1.28 | 1.92 | 2.56 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����ѧ--���ʽṹ�����ʡ�
����ѧ--���ʽṹ�����ʡ� ��b��CH4�� c��CH2=CHCH3��d��CH3CH2C��CH��
��b��CH4�� c��CH2=CHCH3��d��CH3CH2C��CH�� �鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com