
 H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.
H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.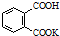 ,摩尔质量为204g•mol-1,易溶于水的固
,摩尔质量为204g•mol-1,易溶于水的固分析 (1)草酸是二元弱酸,分步电离;
(2)①草酸(H2C2O4)为二元中强酸,第一次为氢氧化钠和草酸反应NaOH+H2C2O4═NaHC2O4+H2O,生成草酸氢钠,第二次滴定为草酸氢钠和氢氧化钠反应NaOH+NaHC2O4═Na2C2O4+H2O,生成草酸钠;
②酸、碱能抑制水的电离,酸性减弱,水的电离程度增大,当碱过量,抑制水的电离;
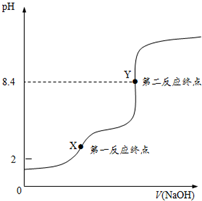
③根据物料守恒、电荷守恒判断,X点时溶液为NaHC2O4溶液,HC2O4-离子水解、电离,Y点时为Na2C2O4溶液;
(3)①根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
②根据KHC8H4O4+NaOH=KNaC8H4O4+H2O来解答;
③根据c(待测碱)=$\frac{V(标准)×c(标准)}{V(待测)}$来分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)草酸是二元弱酸,在水溶液里存在两步电离,第一步电离程度大于第二步,其电离方程式分别为:H2C2O4?HC2O4-+H+、HC2O4-?C2O42-+H+,
故答案为:H2C2O4═HC2O4-+H+,HC2O4-═C2O42-+H+;
(2)①滴定过程中从X点到Y点,为草酸氢钠和氢氧化钠反应,离子反应为:HC2O4-+OH-=C2O42-+H2O,
故答案为:HC2O4-+OH-=C2O42-+H2O;
②用NaOH溶液滴定,开始溶液呈酸性,滴定过程中随着氢离子浓度减小,水的电离程度增大,当滴定完全后,NaOH溶液滴定至过量,溶液呈碱性,抑制水的电离,所以整个过程锥形瓶里溶液中水的电离程度使先增大后减小,
故答案为:d;
③X点时溶液为NaHC2O4溶液,HC2O4-在溶液中发生电离与水解,存在平衡:HC2O4-+H2O?H2C2O4+OH-,碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒由c(Na+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),即c(Na+)-c(C2O42-)=c(H2C2O4)+c(HC2O4-),Y点时为Na2C2O4溶液,
根据电荷守恒有:c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)①,物料守恒由c(Na+)=2[c(HC2O4-)+c(H2C2O4)+c(C2O42-)]②,将②代入①得c(OH-)-c(H+)=c(H2C2O4)+2c(HC2O4-),所以c(OH-)-c(H+)>c(H2C2O4)+c(HC2O4-),
故答案为:=;>;
(3)①邻苯二甲酸氢钾为弱酸,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以用待定NaOH溶液滴定到终点,当无色溶液变成微红色,且半分钟内不褪色,说明反应到终点,
故答案为:滴加最后一滴NaOH溶液时,锥形瓶中溶液变微红色,且半分钟内不褪色;
②0.4896gKHC8H4O4的物质的量为$\frac{0.4896g}{204g/mol}$=0.0024mol,
KHC8H4O4 +NaOH=KNaC8H4O4+H2O
1 1
0.0024mol 0.025L×c(NaOH)
解得:c(NaOH)=0.09600 mol/L
故答案为:0.09600mol•L-1;
③a.碱式滴定管量取NaOH溶液时,未进行润洗操作,导致NaOH溶液浓度降低,故a错误;
b.滴定前滴定管尖端部分有气泡,滴定终点时气泡消失,造成V(待测碱)偏大,根据c(待测碱)=$\frac{V(标准)×c(标准)}{V(待测)}$分析可知c(待测碱)偏小,故b错误;
c.滴定后期用少量蒸馏水稀释锥形瓶中溶液,标准液的物质的量不变,根据c(待测碱)=$\frac{V(标准)×c(标准)}{V(待测)}$分析可知,c(待测)不变,故c错误;
d.读数时,滴定前仰视滴定管刻度,滴定后平视滴定管刻度,造成V(待测碱)溶液体积偏小,根据c(待测碱)=$\frac{V(标准)×c(标准)}{V(待测)}$分析可知c(待测碱)偏大,故d正确.
故答案为:d.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,注意掌握电荷守恒、原子守恒在判断离子浓度大小中的应用方法,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.4 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原溶液中一定含有SCN- | B. | 原溶液中一定含有NO3- | ||
| C. | 原溶液可能呈酸性 | D. | Fe2+被Br2氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 平行试验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com