

| 平行试验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
分析 硫酸铜晶体、NaCl和水加热搅拌,然后向混合溶液中加入Cu、浓盐酸,发生的离子反应方程式为Cu2++4Cl-+Cu=2[CuCl2]-,微沸得到含有钠和氯化铜的混合溶液,将上层溶液倒入水中,发生的反应为Na[CuCl2](易电离,溶液无色)$\frac{\underline{\;水\;}}{\;}$NaCl+CuCl↓,然后抽滤得到固体CuCl和残液,残液中含有氯化钠、硫酸铜,将固体洗涤、烘干得到成品CuCl,
(1)硫酸铜、浓盐酸和Cu能反应生成Na[CuCl2];
(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色;
(3)A.颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过;
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的短导管相接;
C.胶状沉淀易透过滤纸;
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失;
(4)CuCl不溶于乙醇而微溶于水;
(5)氯化亚铜受潮露置空气中迅速氧化成碱式盐;
(6)因为第一次消耗体积与第二次和第三次相差较大,舍去,消耗硫酸铈溶液的平均体积=$\frac{24.05+23.95}{2}$mL=24.00mL,
n(Ce4+)=0.10mol/L×0.024L=0.0024mol,根据Fe2++Ce4+=Fe3++Ce3+、CuCl+FeCl3=CuCl2+FeCl2得
n(CuCl)=n(Fe2+)=n(Ce4+)=0.0024mol,
则m(CuCl)=0.0024mol×99.5g/mol=0.2388g,
样品中CuCl的纯度=$\frac{0.2388g}{0.25g}×100%$.
解答 解:硫酸铜晶体、NaCl和水加热搅拌,然后向混合溶液中加入Cu、浓盐酸,发生的离子反应方程式为 Cu2++4Cl-+Cu=2[CuCl2]-,微沸得到含有钠和氯化铜的混合溶液,将上层溶液倒入水中,发生的反应为Na[CuCl2](易电离,溶液无色)$\frac{\underline{\;水\;}}{\;}$NaCl+CuCl↓,然后抽滤得到固体CuCl和残液,残液中含有氯化钠、硫酸铜,将固体洗涤、烘干得到成品CuCl,
(1)硫酸铜、浓盐酸和Cu能反应生成Na[CuCl2],离子反应方程式为Cu2++4Cl-+Cu=2[CuCl2]-,
故答案为:Cu2++4Cl-+Cu=2[CuCl2]-;
(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色,所以判断反应完全的现象为反应溶液由蓝色转变成无色透明时为止,
故答案为:反应溶液由蓝色转变成无色透明时为止;
(3)A.颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过,则选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀,故A正确;
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的短导管相接,否则易使水进入安全瓶,故B错误;
C.胶状沉淀易透过滤纸而不易采用抽滤方法,故C错误;
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,故D正确;
故选AD;
(4)CuCl不溶于乙醇而微溶于水,水洗涤除去氯化亚铜表面吸附的杂质,提高产品纯度,同时减少产品的溶解,减少损失,所以用乙醇的水溶液洗涤,
故答案为:水洗涤除去氯化亚铜表面吸附的杂质,提高产品纯度,同时减少产品的溶解,减少损失;
(5)氯化亚铜受潮露置空气中迅速氧化成碱式盐,为防止被氧化,步骤⑥烘干须在真空干燥箱中进,
故答案为:氯化亚铜在潮湿的空气中能迅速氧化生成碱式盐而变质;
(6)因为第一次消耗体积与第二次和第三次相差较大,舍去,消耗硫酸铈溶液的平均体积=$\frac{24.05+23.95}{2}$mL=24.00mL,
n(Ce4+)=0.10mol/L×0.024L=0.0024mol,根据Fe2++Ce4+=Fe3++Ce3+、CuCl+FeCl3=CuCl2+FeCl2得
n(CuCl)=n(Fe2+)=n(Ce4+)=0.0024mol,
则m(CuCl)=0.0024mol×99.5g/mol=0.2388g,
样品中CuCl的纯度=$\frac{0.2388g}{0.25g}×100%$=95.5%,
故答案为:95.5%.
点评 本题考查物质制备,为高频考点,侧重考查学生阅读能力、获取信息解答问题能力及知识综合应用能力,明确题干信息、物质性质、实验基本操作等知识点是解本题关键,抽滤在高中化学必修中不涉及,学生对此知识点较陌生,导致回答较困难,注意(6)题第一次消耗溶液体积应该舍弃,为易错点.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
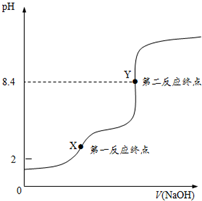 H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.
H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.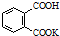 ,摩尔质量为204g•mol-1,易溶于水的固
,摩尔质量为204g•mol-1,易溶于水的固查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积的数值是固定不变的,都约为22.4L | |
| B. | 通常情况的气体摩尔体积约为22.4L | |
| C. | 标准状况下的气体的摩尔体积约为22.4L | |
| D. | 标准状况下,气体的摩尔体积约为22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL 1 mol•L-1的KNO3溶液 | |
| B. | 500 mL 1 mol•L-1的Ba(NO3)2溶液 | |
| C. | 1000 mL 0.5 mol•L-1的Mg(NO3)2溶液 | |
| D. | 1000 mL 0.5 mol•L-1的Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学在能源开发与利用中起着十分重要的作用.
化学在能源开发与利用中起着十分重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com