
【题目】某兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100 mL溶液。
②量取10.00 mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积为20.00 mL。所发生反应的离子方程式如下:H++Fe2++MnO4-![]() Fe3++Mn2++H2O(未配平)
Fe3++Mn2++H2O(未配平)
(1)(NH4)xFe(SO4)2·6H2O中x=____,溶液中c(Fe2+)=___mol·L-1。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外,还有___。
(3)由第②步实验的反应可知还原性:Fe2+___(填“>”或“<”)Mn2+。
(4)计算KMnO4溶液的物质的量浓度,写出计算过程。_____
【答案】2 0.5 100mL容量瓶,玻璃棒 > n(Fe2+)=0.5 mol·L-1×20.00 mL×10-3L·mL-1=0.01 mol
根据配平后离子反应,可得关系式:5Fe2+~MnO4-
n(KMnO4)=0.01 mol÷5=0.002 mol
c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2 mol·L-1
【解析】
(1)(NH4)xFe(SO4)2·6H2O中Fe的化合价为+2价,SO42-的化合价为-2价,NH4+的化合价为+1价,根据化合物的化合价的代数和为0可知:(+1)×x+(+2)+(-2)×2=0,解得x=2;溶液中n[(NH4)xFe(SO4)2·6H2O]=![]() =
=![]() =0.05mol,
=0.05mol,
则c(Fe2+)=c[(NH4)xFe(SO4)2·6H2O]=![]() =
=![]() =0.5mol/L,故答案为:2,0.5。
=0.5mol/L,故答案为:2,0.5。
(2)配制100mL的莫尔盐溶液,所需要的玻璃仪器有量筒、烧杯、胶头滴管、100mL容量瓶、玻璃棒,故答案为:100mL容量瓶,玻璃棒。
(3)反应H++Fe2++MnO4-![]() Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,化合价升高被氧化,作还原剂,所以Fe2+是还原剂,MnO4-中Mn元素的化合价由+7价降低为-2价,化合价降低,被还原,作氧化剂,得到还原产物,所以Mn2+是还原产物,根据氧化还原反应中还原剂的还原性大于还原产物的还原性,所以还原性Fe2+>Mn2+,故答案为:>。
Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,化合价升高被氧化,作还原剂,所以Fe2+是还原剂,MnO4-中Mn元素的化合价由+7价降低为-2价,化合价降低,被还原,作氧化剂,得到还原产物,所以Mn2+是还原产物,根据氧化还原反应中还原剂的还原性大于还原产物的还原性,所以还原性Fe2+>Mn2+,故答案为:>。
(4)反应H++Fe2++MnO4-![]() Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子,MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为8H++5Fe2++MnO4-=5Fe3++Mn2++4H2O,n(Fe2+)=0.5mol·L-1×20.00mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1,故答案为:. n(Fe2+)=0.5mol·L-1×20.00 mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1。
Fe3++Mn2++H2O中,Fe2+中Fe元素的化合价由+2价升高为+3价,失去1个电子,MnO4-中Mn元素的化合价由+7价降低为-2价,得到5个电子,根据电荷守恒和质量守恒配平方程式为8H++5Fe2++MnO4-=5Fe3++Mn2++4H2O,n(Fe2+)=0.5mol·L-1×20.00mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1,故答案为:. n(Fe2+)=0.5mol·L-1×20.00 mL×10-3L·mL-1=0.01mol,根据配平后离子反应,可得关系式:5Fe2+~MnO4-,n(KMnO4)=0.01 mol÷5=0.002mol,c(KMnO4)=0.002 mol÷10 mL×103 mL·L-1=0.2mol·L-1。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】分子式为C5H10O2的有机物R在酸性条件下可水解为酸和醇,下列说法不正确的是
A.这些醇和酸重新组合可形成的酯共有40种
B.分子式与R相同的酸与足量碱石灰共热,最多可得到2种烷烃
C.R水解得到的酸至少有5对共用电子对数目
D.R水解得到的醇发生消去反应,可得到4种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 相同温度时,气体分子间的距离一定相等
B. 2gH2和2gO2能恰好反应生成4gH2O
C. 3.2gO3中含有的氧原子数为1.204×1023个
D. 1 mol·L-1 MgCl2溶液中含Cl-数为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.60gCuSO4固体置于下图所示的装置(固定及夹持类仪器未画出)中加热到1100℃,使其分解,分解过程中可以观察到:石英管中固体由白色变为黑色,最终变为红色;BaCl2溶液中生成白色沉淀,品红溶液褪色,集气瓶中收集到无色气体。
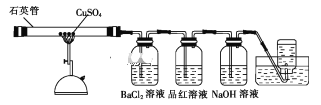
(1)石英主要成分的化学式是_____;高温分解CuSO4固体使用石英管而不使用普通玻璃管的原因是_____。
(2)石英管中剩余红色固体质量为0.72 g,经检测为不含硫元素的纯净物。则该固体的化学式为__。
(3)将BaCl2溶液中生成的白色沉淀过滤并洗涤,向洗涤后的沉淀中加入稀盐酸,无明显现象。
①沉淀的化学式为_____。
②检验沉淀是否洗净的方法是___。
(4)若NaOH溶液足量,则其中发生反应的离子方程式为____。
(5)集气瓶中收集的无色气体是____(填化学式),检验该气体的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 平衡 常数 | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
下列说法正确的是( )
A. K1=12.8
B. T1<T2
C. T1℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
D. 若在T2温度下,向2 L密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
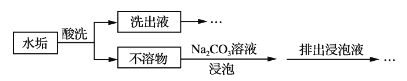
(1)“酸洗”时,一般不选用稀硫酸的原因是_______________________________。
(2)“不溶物”用碳酸钠溶液浸泡的目的是________________________________(用离子方程式表示)。
(3)为防止洗出液中的Fe3+腐蚀铁质管道,常在洗出液中加入SnCl2溶液,反应中Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为________。
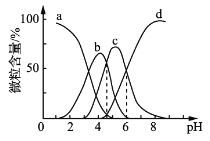
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是_____________________(用平衡移动原理解释)。HR2-电离常数为Ka3,请根据图示信息计算出pKa3=________(pKa3=-lgKa3)。
(5)利用如图2所示装置对锅炉水(含Ca2+、Mg2+、HCO3—)进行预处理,可有效防止锅炉水垢的形成。写出电解过程中,Ca2+形成沉淀的电极反应方程式:______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.②⑤④①③B.④①②⑤③
C.④②⑤①③D.①④②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com