
【题目】请回答下列问题:
(1)(NH4)2SO4中含有化学键的类型为_________________________。
(2)KNO3中NO3-的立体构型为____________________,其中N原子的杂化方式为________,写出与NO![]() 互为等电子体的另一种阴离子的化学式:_______________。
互为等电子体的另一种阴离子的化学式:_______________。
(3)已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50 mL,则该配合物的化学式为________________,Cr在基态时,价电子排布式为_____________________。
(4)LiBH4由Li+和BH4-构成,BH4-的立体构型是____________,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为____________。
(5)丙酮(![]() )分子中C原子轨道杂化类型为_____________;含有的π键与σ键数目之比为___________。
)分子中C原子轨道杂化类型为_____________;含有的π键与σ键数目之比为___________。
(6)第一电离能I 1(Zn)______I 1(Cu)(填“大于”或“小于”),原因是_______________。
【答案】离子键、共价键 平面三角形 sp2 CO32- [CrCl2(H2O)4]Cl·2H2O 3d54s1 正四面体形 H>B>Li sp2 、sp3 1∶9 大于 Zn核外电子排布为全满稳定结构,较难失电子
【解析】
(1)(NH4)2SO4中存在N-H共价键和S-O共价键,铵根离子与硫酸根离子之间存在离子键;故含有化学键的类型为离子键、共价键;
(2)NO3-中价层电子对个数为3且不含孤电子对,所以为平面三角形;硝酸根离子中N原子价层电子对个数是3,杂化方式为sp2杂化;NO3-中有4个原子,5+6×3+1=24个价电子,CO32-有4个原子,4+6×3+2=24个价电子,所以与NO3-互为等电子体的另一种阴离子为CO32-;
(3)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,n(AgNO3)=2molL-1×0.05L=0.1mol,0.1molCrCl36H2O和0.1mol硝酸银反应生成氯化银沉淀,所以该配合物外界氯离子个数是1,则有2个氯原子是配位原子,该配合物的配位数是6,所以有4个水分子是配体,则该配合物的化学式为[CrCl2(H2O)4]Cl·2H2O;根据核外电子排布规律可以写出基态铬价电子排布式为1s22s22p63s23p63s23p63d54s1,所以基态铬(Cr)原子的价电子排布式是3d54s1;
(4)BH4-中B原子价层电子数=4+![]() (3+1-4×1)=4,且不含孤电子对,所以是正四面体形;
(3+1-4×1)=4,且不含孤电子对,所以是正四面体形;
非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li;
(5)丙酮(![]() )分子中甲基上的碳原子为sp3杂化,羰基上的碳原子为sp2杂化;单键全为σ键,1个双键中含有1个π键和1个σ键,故1 mol丙酮中含有1 molπ键和9 mol σ键,含有的π键与σ键数目之比为1∶9;
)分子中甲基上的碳原子为sp3杂化,羰基上的碳原子为sp2杂化;单键全为σ键,1个双键中含有1个π键和1个σ键,故1 mol丙酮中含有1 molπ键和9 mol σ键,含有的π键与σ键数目之比为1∶9;
(6)第一电离能I 1(Zn)大于I 1(Cu),原因是Zn核外电子排布为全满稳定结构,较难失电子。


科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氰基丙烯酸酯是一种用途广泛且具有粘性的材料,其合成原理如图:

已知:RCN在一定条件下,发生水解反应,其产物为RCOOH和NH3。
下列说法正确的是
A.M能使酸性高锰酸钾溶液褪色,不能使溴水褪色
B.上述反应类型是缩聚反应
C.1molM的水解产物最多消耗1molNaOH
D.若R为甲基,N的平均相对分子质量为11100,则n=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组拟设计实验探究乙醇的还原性及产物,装置如图所示。

已知:几种有机物的部分物理性质如表所示:
有机物 | 乙醇 | 乙酸 | 乙醛 |
溶解性 | 易溶于水和乙酸、乙醛 | 易溶于水和乙醇、乙醛 | 易溶于水和乙醇、乙酸 |
沸点 | 78.5 | 117.9 | 20.8 |
(1)为了获得比较稳定的气流,A装置还缺少一种仪器是____(填仪器名称)。A装置使用____(填“冷水浴”或“热水浴”)。
(2)当B中氧化铜完全反应后,正确的操作排序为____(填序号)。
①从C装置中取出试管 ②继续通入乙醇蒸气至B装置中的试管冷却
③熄灭酒精灯 ④从A装置中取出烧瓶
(3)分离和提纯产品。实验完毕后,取少量粗产品于试管,滴加紫色石蕊溶液,溶液变红色,则粗产品中含有___(填化学式)。对粗产品进行____操作(填名称)可以获得较纯的乙醛。
(4)已知:Cu2O呈红色,在酸性条件下发生反应为Cu2O+2H+=Cu+Cu2++H2O。乙同学取少量B中红色粉末于试管,滴加稀硫酸溶液,观察到____(填实验现象),证明红色产物中含有Cu2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯可看作将石墨的层状结构一层一层地剥开得到的单层碳原子;石墨炔是平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能,还可用于H2的提纯;将氢气氢化到石墨烯排列的六角晶格中,使每个碳原子都增加一个氢原子可得最薄的绝缘新材料石墨烷。下列有关说法中不正确的是
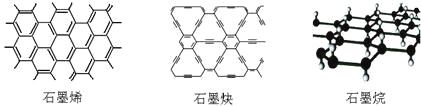
A. 石墨烯和石墨炔互为同素异形体
B. 石墨炔有望替代二氧化硅用作半导体材料
C. 12g石墨烯完全转变为石墨烷需标况下11.2L氢气
D. 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②(CH3)3CBr ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤
②(CH3)3CBr ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑥C. 全部D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:
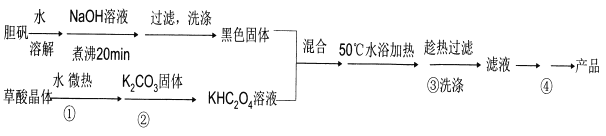
(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是( )
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 生成1molC5H12至少需要2 molH2B. 二氯代物超过两种
C. 所有碳原子均处同一平面D. 与环戊烯互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生,实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
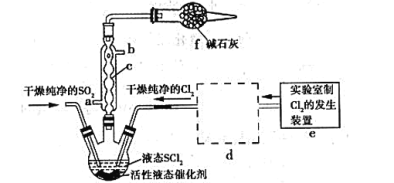
请回答下列问题:
(1)装置f的作用是_____。
(2)实验室用二氧化锰制备Cl2的离子方程式为_____。
(3)SOCl2遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体,写出有关反应的化学方程式_____。
(4)下列制备SO2的原理中最佳选择是____。
A.Cu与浓硫酸混合共热
B.Na2S2O3溶液与稀硫酸混合反应
C.Na2SO3固体与70%的H2SO4混合反应
D.Na2SO3固体与4mol·L﹣1的HNO3混合反应
(5)装置e中产生的Cl2经过装置d后进入三颈烧瓶,d中所用的试剂为___。(按气流方向)
(6)若反应中消耗Cl2的体积为672mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为____(保留三位有效数字)。
(7)实验结束后,将三颈烧瓶中混合物分离开的实验操作是____(己知SCl2的沸点为50℃)。分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com