
【题目】溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。如图为实绘室制备溴乙烷的装置示意图(夹持仅器已略去)。G中盛蒸馏水,实验时选用的药品有:溴化钠、95%乙醇、浓H2SO4。边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。实验室制备溴乙烷的反应原理如下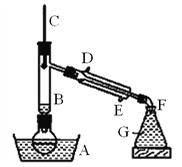
NaBr+H2SO4(浓)![]() NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr→CH3CH2Br+H2O
己知药品的用量:①NaBr(s)0.3mol,②浓硫酸36mL(98%、密度1.84g/cm3),③乙醇0.25mol。
可能存在的副反应有:醇在浓硫酸存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。试问答:
(1)为防止副反应的发生,向圆底烧瓶内加入药品时,还需加入适量的______。
(2)装置B的作用是:①使溴乙烷馏出,②_________。
(3)溴乙烷可用水下收集法的依据是______、_______。
(4)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为____(填编号)。
a.碘化钾溶液b.亚硫酸氢钠溶液c.氢氧化钠溶液
(5)本实验的产率为60%,则可制取溴乙烷______g。
【答案】 水 使沸点高于溴乙烷的物质回流 溴乙烷为有机物 密度比水大且难溶于水 b 16.4
【解析】(1)浓硫酸具有强氧化性,易与NaBr发生氧化还原反应,可能发生的副反应有:2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O,为减少副反应发生,可先加水稀释,防止HBr被氧化;
Br2+SO2↑+2H2O,为减少副反应发生,可先加水稀释,防止HBr被氧化;
(2)装置B的作用,可起到与空气充分热交换的作用,使蒸汽充分冷凝,;
(3)溴乙烷可用水下收集法的依据是,溴乙烷为有机物,密度比水大且难溶于水,水封,防止蒸气逸出,并防止倒吸;
(4)粗产品用水洗涤后有机层仍呈红棕色,是由于溴乙烷溶解了Br2的缘故,可用亚硫酸氢钠溶液洗涤除去,采用亚硫酸氢钠溶液,不用氢氧化钠,是为了防止C2H5Br的水解,故答案为B;
(5)n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,m(溴乙烷)=0.15mol×109g/mol=16.4g。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的物质的量之比为1∶3,则Cl2与NaOH溶液反应时被氧化的氯原子与被还原的氯原子的物质的量之比为( )
A. 4∶1 B. 1∶4 C. 3∶11 D. 11∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的说法不正确的是( )
A. 单质硅常用作半导体材料
B. 硅酸钠是制备木材防火剂的原料
C. 二氧化硅是制备光导纤维的基本原料
D. SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的( )
A. CuCl2 B. FeCl2 C. AlCl3 D. FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是( )
A. 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO![]() +NH
+NH![]() ===BaSO4↓+NH3·H2O+H2O
===BaSO4↓+NH3·H2O+H2O
B. 将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-===SO![]() +Cl-+2H+
+Cl-+2H+
C. 向Fe(NO3)3溶液中加入过量的HI溶液:Fe3++3NO![]() +10I-+12H+===5I2+Fe2++3NO↑+6H2O
+10I-+12H+===5I2+Fe2++3NO↑+6H2O
D. NaHCO3溶液中滴加少量澄清石灰水:2HCO![]() +Ca2++2OH-===CaCO3↓+2H2O+CO
+Ca2++2OH-===CaCO3↓+2H2O+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(w)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。 (导学号52080091)
(1)用10%(密度为1.01 g·cm-3)的氢氧化钠溶液配制成27.5 g 2%的氢氧化钠溶液。
①计算:需____g 10%(密度为1.01 g·cm-3)的氢氧化钠溶液,其体积为___ mL,需加____ mL水[(水)=1 g·cm-3]进行稀释。
②量取:用____ mL量筒量取10%的氢氧化钠溶液,量取时视线要跟量筒内液体____相平,然后倒入烧杯里,用____ mL量筒量取蒸馏水注入烧杯里。
③溶解:用____将上述溶液搅拌均匀,即得27.5 g 2%的氢氧化钠溶液。
(2)把溶质质量分数为98%(密度为1.84 g·cm-3)的浓硫酸稀释成3 mol·L-1的稀硫酸100 mL。
①需要量取浓硫酸____mL;
②配制操作可分解成如下几步,正确的操作顺序是____________(填编号)。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)实验室需配制1 mol·L-1的NaOH溶液和1 mol·L-1的H2SO4溶液各100 mL。
①要配制NaOH溶液,在用托盘天平称取NaOH固体时,托盘天平读数为____(填编号,下同)。
A.4.0 g
B.小于4.0 g
C.大于4.0 g
②在配制NaOH溶液和H2SO4溶液的各步操作中,有明显不同的是____。
A.称量或量取 B.溶解
C.移液、洗涤 D.定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com