
����Ŀ������С�γ���ȼ���������еĶ����������뻯ѧ��ӦϢϢ��ء�
��1����C8H18�������ͷ��ӣ�д��������ȫȼ�յĻ�ѧ����ʽ__________��
��2������������������ȼ�շ�Ӧ��������ȷ����__________��д��ĸ��
A�����;��е����������������������̼��ˮ���е�������
B������ȼ�չ����У���ѧ��ת��Ϊ����
C���������ͺ����������л�ѧ�����յ�����С������̼�������ˮ�л�ѧ���ų�������
D������β���к�NO��ԭ���������к��е�Ԫ�أ�ȼ�պ�����NO
��3�������еĵ�ƿΪǦ���أ�Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O2����֪PbSO4������ˮ������˵����ȷ����__________��д��ĸ��
2PbSO4+2H2O2����֪PbSO4������ˮ������˵����ȷ����__________��д��ĸ��
A���ŵ�ʱ�������ĵ缫��ӦʽΪ��Pb-2e-=Pb2+
B���ŵ�ʱ�������õ��ӵ�������PbO2
C���ŵ�ʱ��������ÿ����20.7gǦ�����·��ת�Ƶĵ���Ϊ0.4mol
D�������ʹ�ŵ�ʱ��������ԭ��Ӧ�������
��4���о�����ȼ�ϵ���У�H2���ڵĵ缫Ϊ__________������������������缫��ӦʽΪ__________������ȼ�ϵ�ص��ŵ���__________������˵��2������
���𰸡� 2C8H18+25O2![]() 16CO2��+18H2O BC BD �� H2-2e-+2OH-=2H2O ����ת��Ч�ʸߣ�����Ⱦ������
16CO2��+18H2O BC BD �� H2-2e-+2OH-=2H2O ����ת��Ч�ʸߣ�����Ⱦ������
����������1��C8H18��ȫȼ������CO2��H2Oʱ��Ӧ�Ļ�ѧ����ʽΪ2C8H18+25O2![]() 16CO2��+18H2O��
16CO2��+18H2O��
��2��A������ȼ���Ƿ��ȷ�Ӧ����μӷ�Ӧ�����ͺ��������е����������������������̼��ˮ���е�����������A����B������ȼ�չ����У�����ת����ʽΪ��ѧ��ת��Ϊ���ܣ���B��ȷ��C������ȼ���Ƿ��ȷ�Ӧ����������ͺ����������л�ѧ�����յ�����С������̼�������ˮ�л�ѧ���ų�����������C��ȷ��D��������̼�⻯��������е�Ԫ�أ�����β���к�NO��ԭ���ǿ����еĵ����ڸ���������ΪNO����D����ΪBC��
��3��A���ŵ�ʱ��ԭ�����PbΪ��������缫��ӦʽΪ��Pb-2e-+SO42-=PbSO4������A����B���ŵ�ʱԭ�����PbO2�������ϵõ��ӷ�����ԭ��Ӧ������PbSO4����B��ȷ��C���ŵ�ʱ��������ÿ����20.7g�����ʵ���Ϊ0.1mol��Ǧ�����·��ת�Ƶĵ���Ϊ0.2mol����C����D�����ʱ���أ������ķ�ӦΪ�ŵ�ʱ��������ԭ��Ӧ�淴Ӧ����D��ȷ����ΪBD��
��4���о�����ȼ�ϵ���У���O2�ļ�Ϊ��������H2���ڵĵ缫Ϊ����������������Ӧ����缫��ӦʽΪH2-2e-+2OH-=2H2O������ȼ�ϵ�����������أ�����������ת��Ч�ʸߣ�����Ⱦ���ŵ㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ڸ������ʵ�Ӧ��˵���������
A. �轺����װʳƷ��������
B. ����������ֽ����Ư��
C. Al(OH)3�����ӵ�����������ȼ��
D. ClO2��һ�ֱ�Cl2����ȫ������ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2H2S(g)��O2(g)===S2(s)��2H2O(l)�� ��H����632 kJ��mol��1����ͼΪH2Sȼ�ϵ�ص�ʾ��ͼ������˵����ȷ����
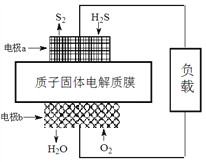
A. �缫aΪ��صĸ���
B. �缫b�Ϸ����ĵ缫��ӦΪ��O2��2H2O��4e��===4OH��
C. ÿ��1mol�����μӷ�Ӧ������ڲ�����632 kJ����
D. ÿ34 g H2S���뷴Ӧ����·����2 mol ����ͨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н����Ǵ�ijͬѧ�ıʼDZ���ժ¼�ģ�����Ϊ���п϶���ȷ����( )
�����뾶Cl����S2����S��F ���⻯����ȶ��� HF��HCl��H2S��H2Se ����ԭ��S2����Cl����Br����I���������� Cl2��S��Se��Te ������ H2SO4��HClO4��H2SeO4���õ�������F��Cl��Br��I
A. ֻ���� B. �٢ۢ� C. �ڢܢ� D. ֻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����
A. ϡ���������м��Ӧ��3Fe+8H++2NO3-=3Fe3++2NO��+4H2O
B. ��������Һ�����İ�ˮ��ӦAg++3NH3��H2O=Ag(NH3)2OH+NH4++2H2O
C. ̼������Һ�м���������ӣ�![]()
D. ��NH4Al(SO4)2��Һ�м��������Ba(OH)2��Һ��Al3++2SO42-+4OH-=2BaSO4��+AlO2-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�����رջ�������Ʒ����Һ�ޱ仯��ʯ����Һ��죬����ʯ��ˮ����ǣ�����������Ʒ����Һ��ɫ��ʯ����Һ��죬����ʯ��ˮ�����ǡ��ݴ��ж�������ƿ��ʢ�ŵ����ʷֱ��ǣ� ��

A. SO2��ŨH2SO4 B. Cl2��NaHCO3��Һ
C. CO2��Na2CO3��Һ D. SO2��NaHCO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ���ǣ� ��
A. ���³�ѹ�£�56 g��ϩ�ͱ�ϩ�Ļ�����к��е�̼ԭ����Ϊ4NA
B. 1.2 g NaHSO4�����к��е������Ӻ������ӵ�����Ϊ0.03NA
C. 12 g���ʯ�к��еĹ��ۼ���Ϊ4NA
D. 1 mol Fe2����������H2O2��Һ��Ӧ��ת��2NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2����Ҫ�Ļ���ԭ�ϣ�������ɵĻ�������Ҳ���������ǵĹ�ע������Ѱ��SO2�ĺ������Ʒ��Ŀǰ������ҵ���¶�̬��
��1��SO2������ˮ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ____________________________________��SO2�Ǵ�������Ҫ��Ⱦ������__________________�ĸ�Դ��
��2����ҵ�ϳ��û�����FeS2���Ʊ�SO2����������S�Ļ��ϼ�Ϊ____________�����������պ�����1.6gFe2O3��ת�Ƶĵ�����Ϊ________��
��3����ҵ��ʹ�ü�Һ����SO2��ʹ�ŷŵ�β���ﵽ�ϸ����
�ٽ���״����11.2LSO2ͨ�뵽2L0.5mol��L-1�İ�ˮ�У�������Һ��������_________���ѧʽ����
�ڳ����£�����1LNaOH��������0.01molSO2����ȫ���պ���Һ��c��Na+��=c��SO32-��+c��HSO3-��+c��H2SO3������ԭNaOH��Һ��pHֵΪ________��
��4�������������ƣ�Na2S2O4����SO2���ƣ����м�ǿ�Ļ�ԭ�ԣ������ڱ���ˮ��ʳ��ֿ�����ͼ��ʾ����ͨ������SO2��NO�����Na2S2O4��NH4NO3��GeΪ��Ԫ�أ�

��װ��II�У����������£�NO��Ge4+�����IJ�����Ҫ��NO3-��NO2-����д�����ɵ����ʵ�����NO3-��NO2-�����ӷ���ʽ��_______________________________��
��װ��III������֮һ�������ӽ���Ĥ���۵��ʹ��Ge4+������ͬʱ����һ������S2O42-�ĵ缫��ӦʽΪ___________________________��
��5���ֽ�ѧ�����з�����SO2����ȫ��ƫ���������Σ�K2S2O5������ҵ�ϳ���2KHSO3=K2S2O5+H2O�ķ����Ʊ����ҹ�Ҫ����������K2S2O5�ı���������Ԫ��������SO2�ƣ�Ϊ0.25g/L��������500�����Ѿƣ������K2S2O5������Ϊ_______�������ѾƵ��ܶȽ���Ϊˮ������������С�����2λ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com