
【题目】![]() 是褐色固体,受热分解为Pb的
是褐色固体,受热分解为Pb的![]() 和
和![]() 价的混合氧化物,
价的混合氧化物,![]() 价的Pb能氧化浓盐酸生成
价的Pb能氧化浓盐酸生成![]() ,
,![]() 价的Pb还原成
价的Pb还原成![]() 价的Pb;现将
价的Pb;现将![]() 加热分解得到
加热分解得到![]() ,向剩余固体中加入足量的浓盐酸得到
,向剩余固体中加入足量的浓盐酸得到![]() ,
,![]() 和
和![]() 的物质的量之比为
的物质的量之比为![]() ,则剩余固体的组成及物质的量比是
,则剩余固体的组成及物质的量比是![]()
![]()
A.![]() 混合的
混合的![]() 、
、![]() B.
B.![]() 混合的
混合的![]() 、PbO
、PbO
C.![]() 混合的
混合的![]() 、
、![]() 、PbOD.
、PbOD.![]() 混合的
混合的![]() 、
、![]() 、PbO
、PbO
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】Cl2、漂白液(有效成分为 NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解 NaCl 溶液生成Cl2的化学方程式是________________。
(2)Cl2溶于H2O、NaOH 溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是_____。
②25℃,Cl2与H2O、NaOH 的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
解释不直接使用氯水而使用漂白液做消毒剂的原因_____。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式为____________。
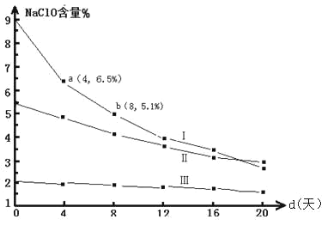
(4)研究漂白液的稳定性对其生产和保存有实际意义。30℃时,pH=11 的漂白液中NaClO 的质量百分含量随时间变化如下:
比较分解速率 v(I)、 v(II)的大小关系_____,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,铝土矿![]() 含有
含有![]() 、FeO、
、FeO、![]() 、
、![]() 等物质
等物质![]() 用硫酸浸。下列说法中错误的是
用硫酸浸。下列说法中错误的是![]()
![]()
A.向浸出后的溶液加入过量NaOH溶液后存在:![]() 、
、![]() 、
、![]() 、
、![]()
B.向浸出后的溶液加入过量氨水后存在:![]() 、
、![]() 、
、![]() 、
、![]()
C.向浸出后的溶液通入过量HI后存在:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
D.若铝土矿改用NaOH溶液浸,浸出后的溶液中存在:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是__________(填序号)。
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液退色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.二甲苯 和
和 的结构不同,互为同分异构体
的结构不同,互为同分异构体
D.苯分子中的12个原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子 PVA 可用于制滴眼露液,还可制成人工肾膜等医疗产品。由电石(CaC2)合成 PVA 的过程如下:
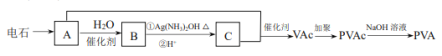
已知:VAc 的结构简式为 CH3COOCH=CH2 。
(1)电石制备 A 的化学方程式是_________________。
(2)B 与银氨溶液反应的化学方程式是_________________。
(3)PVA 的结构简式是__________________。
(4)聚乙烯醇肉桂酸酯的结构简式为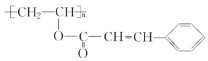 ,它是一种感光性高分子树脂。其单体可由 A 和肉桂酸(
,它是一种感光性高分子树脂。其单体可由 A 和肉桂酸( ![]() )合成,该反应的化学方程式是________________________________。
)合成,该反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,其结构简式如图所示:

(1)该物质的分子式是___________________。
(2)该物质分子中含有的官能团有羟基、碳碳双键和___________________。
(3)1mol 该物质与足量 NaOH 溶液反应,最多消耗 NaOH___________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烷和乙烯都能制得一氯乙烷。
(1)由乙烷制一氯乙烷的化学方程式为____________,反应类型为______________。
(2)在催化剂作用下,由乙烯制一氯乙烷的化学方程式为____________,反应类型为______________。
(3)以上两种方法中_________[填“(1)”或“(2)”]更适合用来制取一氯乙烷,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种常用的工业燃料,乙醇的生产过程可用下图表示:

已知:![]() 。
。
(1)粉碎玉米的目的是____________________。
(2)请写出“发酵”过程中发生反应的化学方程式_________________;发酵产生的CO2的纯度可达到99%,可回收利用,请举出它的两项用途:________________、_________________。
(3)操作a的名称是_____________,检验乙醇中是否含有水可以用试剂 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如下:

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水。在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。高锰酸钾具有强氧化性。高锰酸钾(K2FeO4)与水作用产生Fe(OH)3。
(1)检验废液中含有Fe2+选用的试剂是________(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是_________(填化学式),加入时发生反应的离子方程式为__________。
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是_________和__________。
(3)“氧化”过程反应的离子方程式为__________。
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和________,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用_________溶解,然后________。
(5)用回收的铜为原料可制得粗制CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4·5H2O的晶体。
已知:室温时一些物质的Kaq如下表:
化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
已知溶液中的离子浓度小于1×10-6mol·L-1时就认定沉淀完全。
加双氧水的目的是__________;若溶液中CuSO4的浓度为3.0mol·L-1,通过计算说明此方法可除去粗制CuSO4·5H2O晶体中FeSO4·7H2O的理由________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com