
【题目】 R2O7n-离子在一定条件下可以把XO32-离子氧化为XO42-,若R2O7n-离子变为R3+离子。又知反应中R2O7n-与XO32-的物质的量之比为1:3,则R2O7n-中R元素的化合价为( )
A.+4B.+5C.+6D.+7
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:
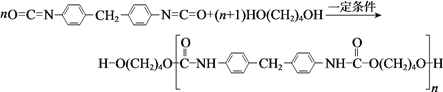
下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名或主要成份与化学式相对应的是( )
A.苏打——NaHCO3B.生石灰 Ca(OH)2
C.漂白粉——Ca(ClO)2和CaCl2D.纯碱——NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为: N2(g)+H2(g)=2NH3(g) △H<0
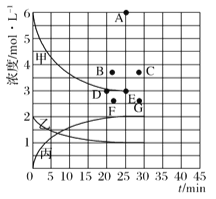
(1)右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)

A.t1→t1 B.t2→t3 C.t3→t4 D.t5→t6
t4时改变的条件是________________。
进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L,则此时V正_____V逆 (填">"“<”或“=”)。
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升_____?
(2)反应后溶液中各溶质的离子浓度是多少 ______? (反应完溶液中溶质的离子有Cu2+、H+、、NO3-、 SO42-)(以上要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物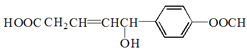 的性质叙述正确的是
的性质叙述正确的是
A. 1mol该有机物最多可以与6mol H2发生反应
B. 1mol该有机物最多可以与3molNa发生反应
C. 1mol该有机物最多可以与3mol NaOH发生反应
D. 1mol该有机物最多可以与2mol NaHCO3发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项括号内为杂质,后面为除杂质操作,其中正确的是( )
A.乙酸乙酯(乙酸),加NaOH溶液、分液
B.福尔马林(乙酸),加Na2CO3溶液、分液
C.溴乙烷(乙醇),加水振荡、分液
D.苯(苯酚),加溴水振荡、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的有机化工原料,广泛用于合成橡胶、塑料和医药等方面。下列关于苯的叙述正确的是( )
A. 分子式为C6H6B. 属于不饱和烃C. 能在空气中燃烧D. 无色无毒的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是______。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com