
【题目】苯是一种重要的有机化工原料,广泛用于合成橡胶、塑料和医药等方面。下列关于苯的叙述正确的是( )
A. 分子式为C6H6B. 属于不饱和烃C. 能在空气中燃烧D. 无色无毒的液体
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 R2O7n-离子在一定条件下可以把XO32-离子氧化为XO42-,若R2O7n-离子变为R3+离子。又知反应中R2O7n-与XO32-的物质的量之比为1:3,则R2O7n-中R元素的化合价为( )
A.+4B.+5C.+6D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
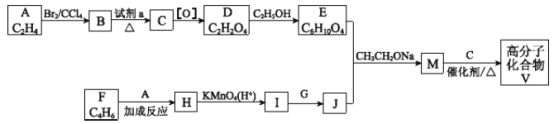
【题目】高分子化合物V (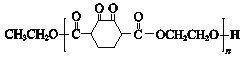 )是人造棉的主要成分之一,合成路线如下:
)是人造棉的主要成分之一,合成路线如下:
已知:I.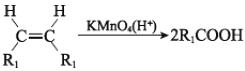
II.![]()
III.
(R、R1、R2、R3 表示烃基)
(1)A的名称是________________________。
(2)试剂a是__________________________。
(3) F与A以物质的量之比1∶1发生反应生成六元环状化合物H,H的结构简式是_______。
(4)I的结构简式是________________________。
(5)G的结构简式是_______________________________;E与J反应生成M的化学方程式是_______________________________________________。
(6)M与C反应生成V的化学方程式是____________________________。
(7)E的同分异构体N也可以和J反应生成M,N可能的结构简式是_______(写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中常含有少量的泥沙及氯化钙、氯化镁、硫酸盐等一些可溶性的杂质。粗盐的提纯实验操作步骤如下图所示:

① ② ③
(1)请写出图中各步实验操作的名称①________,②________,③________。
(2)实验操作②的主要目的是____________________。
(3)实验操作③的目的是________________________。
(4)实验操作①②③中都使用的仪器是________,它在③中其作用是____________________。
(5)通过上述实验操作,得到的精盐中可能含有的杂质是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如图所示,下列有关说法不正确的是 ( )
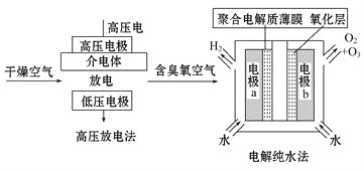
A. 高压放电法,反应的原理为3O2![]() 2O3
2O3
B. 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C. 电解纯水时,电极b周围发生的电极反应有6OH--6e-=O3↑+3H2O和4OH--4e-=O2↑+2H2O
D. 电解水时,H+由电极a经聚合电解质薄膜流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24LSO3分子数为0.1NA
C. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
D. 0.1molNa2O2与足量潮湿的二氧化碳反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)在元素周期表中M位于_____区,基态M原子的价层电子排布图为_____,第四能层s轨道上电了数目和M元素相同的元素还有_____(填元素符号)。
(2)元素Y基态原子的核外电子排布式为_______,其同周期元素中,第一电离能最大的是____(写元素符号)。元素Y的含氧酸中,酸性最强的是_____(写化学式),该酸根离子的立体构型为_______。
(3)Z与元素Y同主族,在该族中原子序数最小,Z的气态氢化物的稳定性大于Y的气态氢化物的稳定性,原因是__________,Z的气态氢化物的沸点大于Y的气态氢化物的沸点,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数。下列有关NA的叙述中,正确的是( )
A. 1 mol 任何物质所含的分子数均为NA
B. 14 g氮气所含的氮原子数为NA
C. 标准状况下,22.4 L水所含的水分子数为NA
D. 在钠与氯气的反应中,1 mol钠失去电子的数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com